लेखक : उमा सुधीर
अनुवाद एवं संपादन : सुशील जोशी [Hindi PDF, 474kB]
वैज्ञानिकों, दार्शनिकों या विचारकों ने हमारे आसपास पाए जाने वाले ठोस, द्रव और गैस की प्रकृति के बारे में जितना जानने की कोशिश की उतनी ही नई-नई बातें सामने आती गईं।
अरिस्टोटल का विचार था कि प्रकृति का हरेक पदार्थ चार तत्वों - हवा, पानी, पृथ्वी और आग के अलग-अलग अनुपातों से मिलकर बना है। बाद में उसने ईथर भी जोड़ दिया। उसका यह विचार लगभग 17वीं सदी तक मान्य रहा। रॉबर्ट बॉयल ने जब रासायिनक तत्वों के संदर्भ में नए विचार प्रस्तुत किए तब पुराने विचारों को लेकर सवाल उठाए जाने लगे।
एक समय जहां एक दर्जन तत्वों की जानकारी थी, वहीं आज लगभग 110 तत्वों की लंबी सूची मौजूद है। वैसे यह भी सच्चाई है कि रोज़मर्रा की ज़िंदगी में हमारा पाला लगभग 30 तत्वों से ही पड़ता होगा। ये 30 तत्व भी हमारे आसपास यौगिकों के रूप में बिखरे होते हैं। हम काफी कम संख्या में तत्वों को मुक्त अवस्था में पाते हैं। यदि हम फ्री-एलिमेंट के उदाहरणों को देखना शु डिग्री करें तो सबसे प्रचुरता से पाया जाने वाला तत्व कार्बन है जो कोयले और हीरे के रूप में दिखाई देता है। गंधक गर्म पानी के झरनों, प्रदूषित पानी वाले इलाकों में मुक्त रूप में पाया जाता है। सोना भी मुक्त रूप में पाया जाता है लेकिन पृथ्वी पर कुल मिलाकर सोना बहुत कम है। ऐसा माना जाता है कि पृथ्वी के भीतर केन्द्रीय क्रोड में लोहा काफी मात्रा में मुक्त रूप में पाया जाता है।
यदि और पड़ताल करें तो नौ ऐसे तत्व हैं जो सामान्य परिस्थितियों में गैसीय अवस्था में पाए जाते हैं। ये हैं - ऑक्सीजन, नाइट्रोजन, हीलियम, नियॉन, आर्गन, क्रिप्टॉन, ज़िनॉन और हाइड्रोजन।
वे कौन-से कारण हैं जिनकी वजह से तत्व प्रकृति में यौगिक बनाए बगैर भी पाए जाते हैं? कुछ कारण तो समझ में आते हैं जैसे - अक्रिय गैसें अन्य तत्वों के साथ स्थाई यौगिक नहीं बना पाती। सोना और प्लेटिनम अन्य तत्वों के साथ यौगिक तो बनाते हैं लेकिन काफी कठिनाई से, और उनके यौगिक आसानी से टूटकर सोने या प्लेटिनम को फ्री-एलिमेंट के रूप में निकल जाने देते हैं। हाइड्रोजन, सल्फर और ऑक्सीजन काफी क्रियाशील तत्व हैं और आसानी से स्थाई यौगिक बनाते हैं, फिर भी बैक्टिरिया, प्राणियों और वनस्पतियों द्वारा इनका बार-बार पुन: निर्माण किया जाता है इसलिए ये लगातार वायुमंडल में पहुंचते रहते हैं।
लेकिन इन सब में नाइट्रोजन की बात थोड़ी निराली है। वायुमंडल का 79 प्रतिशत हिस्सा मुक्त गैसीय नाइट्रोजन से बना हुआ है। यह आसानी से रासायनिक बंधन नहीं बनाता और फ्री-एलिमेंट की तरह पाया जाता है। एक बार यदि नाइट्रोजन के यौगिक बन जाएं तो वे काफी स्थाई होते हैं। पेड़-पौधे, जीव-जन्तुओं में नाइट्रोजन के यौगिक प्रोटीन, न्यूक्लिक एसिड या विटामिन किसी-न-किसी रूप में मौजूद होते हैं। प्रकृति में कुछ बैक्टिरिया वगैरह को छोड़ दिया जाए तो शेष जीव-वनस्पति वायुमंडल की नाइट्रोजन का सीधे-सीधे उपयोग नहीं कर पाते। फिर भी सभी अपने-अपने तरीके से अपने लिए नाइट्रोजन का जुगाड़ बना ही लेते हैं।
खैर, हम यहां इस लेख को दो हिस्सों में दे रहे हैं। पहले नाइट्रोजन की अक्रियाशीलता को आणविक स्तर पर जाकर समझने की कोशिश करेंगे और दूसरे हिस्से में प्रकृति में नाइट्रोजन चक्र के बारे में विस्तार से पढ़ेंगे।
युमंडल में 78 प्रतिशत नाइट्रोजन और 21 प्रतिशत ऑक्सीजन है। ऑक्सीजन तो सारे ऑक्सीजन आधारित जीवों के लिए ज़रूरी है। शायद आपको लगे कि काश वायुमंडल में इन गैसों का अनुपात पलट जाए; ऑक्सीजन 78 प्रतिशत हो जाए और नाइट्रोजन 21 प्रतिशत रह जाए, तो श्वसन में कितनी आसानी होगी, नहीं? मगर यह सही नहीं है। यदि अचानक हमारा वायुमंडल ऑक्सीजन संपन्न हो जाए, तो हम सब लोग स्वत: दहन के शिकार हो जाएंगे। अनुपात पलटना तो दूर की बात है, यदि हवा में ऑक्सीजन का अनुपात बढ़कर 25 प्रतिशत भी हो जाए, तो कटिबंधीय जंगलों की गीली लकड़ियां भी जलने लगेंगी और जंगल की आग बेकाबू हो जाएगी। लिहाज़ा, हवा में अत्यंत निठल्ली गैस नाइट्रोजन की उपस्थिति धरती पर जीवन की विविधता के लिए ज़रूरी है।
नाइट्रोजन जीवन के महत्वपूर्ण अणुओं में भी पाई जाती है; जैसे न्यूक्लिक अम्ल और प्रोटीन्स। देखा आपने, अक्रिय होने के बावजूद सजीव जगत में नाइट्रोजन तत्व का भरपूर उपयोग होता है।
यहां मैं दो परस्पर सम्बंधित मुद्दों पर चर्चा करना चाहूंगी। एक है नाइट्रोजन का निठल्लापन और दूसरा है कि जैविक तंत्र इस अत्यंत अक्रिय तत्व का उपयोग अमीनो अम्ल व अन्य नाइट्रोजन आधारित पदार्थों के निर्माण में कैसे कर लेते हैं जो सारे जीवों के लिए अनिवार्य हैं।
तो पहले आसान समस्या पर धावा बोलते हैं - नाइट्रोजन इतनी अक्रिय या इतनी स्थिर क्यों है? इसी सवाल को दूसरे शब्दों में इस तरह पूछ सकते हैं कि क्यों नाइट्रोजन का द्वि-परमाणविक अणु सामान्य हालात में रासायनिक क्रियाओं में भाग लेने के प्रति इतना अनिच्छुक होता है जबकि उन्हीं हालात में ऑक्सीजन क्रियाएं करती चली जाती है? दूसरा सवाल हम थोड़ी देर बाद उठाएंगे।
अक्रियता
तत्वों की क्रियाशीलता का अर्थ यह होता है कि वह तत्व अन्य तत्वों या स्वयं अपने परमाणुओं के साथ जुड़कर अणु बनाने की कितनी तत्परता दिखाता है। विभिन्न तत्वों के बीच सक्रियता में अंतर होता है और इस अंतर को आम तौर पर इस आधार पर समझाया जाता है कि सारे परमाणु अपनी सबसे बाहरी कक्षा में अक्रिय या उत्कृष्ट गैसों जैसा विन्यास हासिल करने की फिराक में रहते हैं। इसी बात को दूसरे शब्दों में यों कहेंगे कि एक पूर्ण रूप से भरी हुई बाहरी कक्षा स्थिरता प्रदान करती है।
हीलियम के अलावा समस्त अन्य उत्कृष्ट गैसों की सबसे बाहरी कक्षा में 8 इलेक्ट्रॉन होते हैं। लिहाज़ा यह कहा जाता है कि तत्व क्रिया करते हैं ताकि अपने ख़् आवरण में 2 इलेक्ट्रॉन हासिल कर लें या अन्य बाह्य आवरण में 8 इलेक्ट्रॉन। जैसे ही किसी परमाणु की बाह्य कक्षा का इलेक्ट्रॉन विन्यास निकटतम अक्रिय गैस जैसा हो जाता है, वह अधिक स्थिर हो जाता है। कोई भी परमाणु यह स्थिर इलेक्ट्रॉन विन्यास तीन तरह से हासिल कर सकता है। इलेक्ट्रॉन को त्यागकर, इलेक्ट्रॉन को किसी अन्य परमाणु से प्राप्त करके या किसी अन्य परमाणु के साथ साझा करके। वैसे, उपयुक्त परिस्थितियां मिलें तो कई तत्व व यौगिक अन्य तत्वों और यौगिकों से इसके बाद भी क्रिया करते हैं।
दरअसल, जब हम कहते हैं कि दो परमाणुओं के बीच बंधन बना है तो कहने का मतलब यह है कि अलग-अलग परमाणु की अपेक्षा उन जुड़े हुए परमाणुओं की ऊर्जा कम है। इसीलिए तो यह संकुल (अणु) अलग-अलग परमाणुओं की अपेक्षा अधिक स्थिर है। इलेक्ट्रॉनों के लेन-देन और ऊर्जा के इस अंतर्सम्बंध को समझने के लिए मूलत: दो सिद्धांत हैं - संयोजी बंधन (वेलेंस बॉण्ड) सिद्धांत और आणविक कक्षक (मॉलीक्यूलर ऑर्बिटल) सिद्धांत। आइए देखें कि इन दो सिद्धांतों के तहत इस बात को कैसे समझते हैं।
वेलेंस बॉण्ड सिद्धांत
वेलेंस बॉण्ड सिद्धांत के तहत यह माना जाता है कि परमाणु जब पास-पास आते हैं तो उनके इलेक्ट्रॉन कक्षक एक-दूसरे पर पसर जाते हैं; तकनीकी भाषा में कहते हैं कि परस्पर व्याप्त (ओव्हरलैप) हो जाते हैं। इस परस्पर व्याप्ति के कारण पूरे तंत्र की ऊर्जा कम हो जाती है। (देखिए चित्र 2 एवं 3)
ज़रा इस बात पर ध्यान दें कि कक्षक किस तरह से एक-दूसरे पर पसरे हैं। इनमें से एक सहसंयोजी बंधन में तो कक्षक एक-दूसरे पर सीधे-सीधे पसरे हैं। इस तरह की परस्पर व्याप्ति से सिग्मा (σ) बंधन बनता है (चित्र 5)। अन्य बंधनों में ऑर्बिटल्स की परस्पर व्याप्ति बाजू से है जिससे पाई (π) बंधन बनते हैं (चित्र 6)।
किसी भी अणु में π बंधन की उपस्थिति उसे आम तौर पर अत्यंत क्रियाशील बना देती है। जैसे एसिटिलीन H–C≡C–H पर विचार कर सकते हैं जिसमें दो कार्बन के बीच में तीन बंधन होते हैं। इनमें से एक σ बंधन है और दो π बंधन (चित्र 6)। एसिटिलीन कई अभिकारकों के साथ योग क्रियाएं करती है जिसमें π बंधन टूटकर नए बंधन बनते हैं। नाइट्रोजन में भी इसी तरह के बंधन हैं मगर अपेक्षा के विपरीत यह अक्रिय है।
नाइट्रोजन के अणु की तुलना हम ऑक्सीजन के अणु से भी कर सकते हैं। ऑक्सीजन में दो सहसंयोजी बंधन होते हैं जिनमें से एक σ बंधन और दूसरा π बंधन होता है। ऑक्सीजन के प्रत्येक परमाणु के पास एक-एक जोड़ा स्वतंत्र इलेक्ट्रॉन्स का होता है, जो बंधन में शरीक नहीं होते।
एसिटिलीन के ही समान ऑक्सीजन का अणु भी काफी क्रियाशील है और कई तत्वों व यौगिकों के साथ आसानी से क्रिया करता है। ऐसी स्थिति में हम नाइट्रोजन अणु की अक्रियता की व्याख्या कैसे करें जो ऐसा कोई व्यवहार करने से इन्कार करता है और अकेला रहना ही पसंद करता है। यानी वेलेंस बॉण्ड सिद्धांत नाइट्रोजन अणु की स्थिरता की व्याख्या करने में असमर्थ है।
आणविक कक्षक सिद्धांत
इस मामले में आणविक कक्षक सिद्धांत कहीं ज़्यादा संतोषजनक साबित होता है। इस सिद्धांत में प्रत्येक परमाणु के इलेक्ट्रॉनों की व्यवस्था को पूरे अणु में फैलाकर देखा जाता है। कक्षक दरअसल किसी भी इलेक्ट्रॉन की ऊर्जा की स्थिति को दर्शाते हैं। परमाणुओं में इलेक्ट्रॉन्स एक केंद्रक के आसपास कक्षकों में स्थित रहते हैं। अणुओं में आणविक कक्षक होते हैं जिनका कोई एक केंद्रक नहीं होता। अर्थात अणुओं में कोई भी इलेक्ट्रॉन किसी भी केंद्रक के आसपास पाया जा सकता है। दूसरे शब्दों में बंधन बनने का मतलब ही है कि परमाणविक कक्षक आपस में घुल मिलकर आणविक कक्षकों का निर्माण करते हैं। यानी आणविक कक्षक मॉडल में परमाणु कक्षक टूटकर नए सिरे से आणविक कक्षकों का निर्माण करते हैं। इलेक्ट्रॉन इन आणविक कक्षकों में स्थित होते हैं। ये आणविक कक्षक बंधक (यानी बॉण्डिंग) या प्रतिबंधक (यानी एंटीबॉण्डिंग) हो सकते हैं।
बॉण्डिंग कक्षकों को ऐसे कक्षक माना जा सकता है जो दो केंद्रकों के बीच स्थित होते हैं। अत: उनकी ऊर्जा उन परमाणविक कक्षकों से कम होती है जिनके मेल से वे बने हैं। दूसरी ओर, एंटीबॉण्डिंग कक्षक वे आणविक कक्षक हैं जो केंद्रकों के बीच स्थित नहीं होते। इनमें उपस्थित इलेक्ट्रॉनों की ऊर्जा मूल परमाणविक कक्षकों से अधिक होती है। यहां ध्यान देने की बात है कि परमाणु कक्षकों से आणविक कक्षक बनने का मतलब यह नहीं है कि उन सारे आणविक कक्षकों में इलेक्ट्रॉन मौजूद हों।
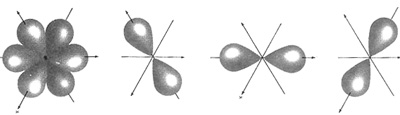
इस बात को चित्र-7 के उदाहरण से समझते हैं।
दो केंद्रकों के बीच उपस्थित इलेक्ट्रॉनों पर दोनों केंद्रकों का आकर्षण बल लगता है और इस वजह से अणु को स्थिरता प्राप्त होती है। दूसरी ओर एंटीबॉण्डिंग कक्षकों में स्थित इलेक्ट्रॉन अस्थिरता पैदा करेंगे। एक बार आपने हिसाब-किताब करके बॉण्डिंग व एंटीबॉण्डिंग कक्षक बना लिए तो फिर सारे उपलब्ध इलेक्ट्रॉनों को इन कक्षकों में इलेक्ट्रॉन वितरण के नियमों के अनुसार डाला जाता है। लिहाज़ा यदि एंटीबॉण्डिंग कक्षकों की अपेक्षा बॉण्डिंग कक्षकों में ज़्यादा इलेक्ट्रॉन हैं तो हमें एक अपेक्षाकृत स्थिर अणु मिलेगा। किसी भी अणु की स्थिरता को हम बंधन श्रेणी से दर्शा सकते हैं:
बंधन श्रेणी = (बॉण्डिंग इलेक्ट्रॉन की संख्या – एंटीबॉण्डिंग इलेक्ट्रॉन की संख्या)/2
अर्थात बंधन श्रेणी किन्हीं दो परमाणुओं के बीच बने बंधन की संख्या एवं शक्ति की द्योतक है।
यहां एक बात गौरतलब है। वैसे तो हम यौगिक में मौजूद परमाणुओं के सारे कक्षकों के आणविक कक्षक बना सकते हैं। मगर परमाणुओं के बंधन की दृष्टि से आम तौर पर बाहरी कक्षक के इलेक्ट्रॉन का विश्लेषण ही पर्याप्त होता है। कुछ मामलों में बाहरी से एक अंदर वाले कक्षक को भी ध्यान में लेना पड़ता है।
यदि हम दो हाइड्रोजन परमाणुओं के बीच बने बंधन को देखें तो चित्र-8 जैसी स्थिति नज़र आएगी।
इसमें बंधन श्रेणी 1 है और दोनों परमाणुओं के इलेक्ट्रॉन को σ1s बॉण्डिंग कक्षक में स्थान मिला है। इसके आधार पर He2 अणु के अस्तित्व की व्याख्या हो जाती है।
यदि हम यही कोशिश He2 के संदर्भ में करें तो चित्र-9 जैसी स्थिति सामने आएगी।
इस मामले में बंधन श्रेणी शून्य है क्योंकि σ1s2 बॉण्डिंग कक्षक और σ*1s2 एंटीबॉण्डिंग कक्षक में इलेक्ट्रॉन की संख्या बराबर है। इसलिए स्थिरता में कुल मिलाकर कोई इज़ाफा नहीं हुआ है और यह अणु नहीं बनेगा। आप जानते ही हैं कि क्तड्ढ मुक्त परमाणु के रूप में ही पाया जाता है। 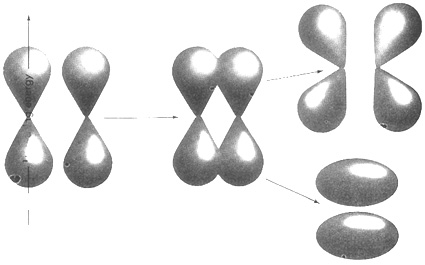 चलिए नाइट्रोजन पर लौटते हैं। नाइट्रोजन का आणविक कक्षक मॉडल चित्र-10 की तरह दिखेगा।
चलिए नाइट्रोजन पर लौटते हैं। नाइट्रोजन का आणविक कक्षक मॉडल चित्र-10 की तरह दिखेगा।
विश्लेषण के लिए हम दोनों परमाणुओं के 2p कक्षक ले लेते हैं। ये छह परमाणविक कक्षक एक-दूसरे पर पसरकर तीन बॉण्डिंग और तीन एंटीबॉण्डिंग कक्षक बनाते हैं। इनमें से दो कक्षक σ और σ*। हैं। अन्य दो ऑर्बिटल्स π हैं। कुल संयोजकता इलेक्ट्रॉन 6 हैं। ये 6 इलेक्ट्रॉन्स एक σ व दो π बॉण्डिंग कक्षक में बंट जाते हैं जबकि सारे एंटीबॉण्डिंग कक्षक खाली ही रहते हैं। इसलिए नाइट्रोजन अणु की ऊर्जा अलग-अलग परमाणुओं की ऊर्जा के योग से कम है। नाइट्रोजन अणु की बंधन श्रेणी 3 है जिससे पता चलता है कि यह अणु काफी टिकाऊ है। अर्थात नाइट्रोजन अणु बनने के दौरान काफी स्थिरता हासिल होती है और इस वजह से नाइट्रोजन का अणु एक टिकाऊ अणु है।
आइए, ऑक्सीजन के अणु पर फिर से एक नज़र डालें और देखें कि आणविक कक्षक के आधार पर उसकी व्याख्या कैसे होती है (चित्र-11)।
ऑक्सीजन के सबसे बाहरी कक्षक में 6 इलेक्ट्रॉन हैं - दो इलेक्ट्रॉन 2s कक्षकों में और 4 इलेक्ट्रॉन 2p कक्षकों में। आणविक कक्षक मॉडल दर्शाता है कि p ऑर्बिटल्स के 8 इलेक्ट्रॉन्स इस तरह बंटते हैं कि 6 तो बॉण्डिंग कक्षकों में होते हैं जबकि 2 एंटीबॉण्डिंग कक्षकों में। लिहाज़ा ऑक्सीजन की बंधन श्रेणी 2 है। दो इलेक्ट्रॉन्स का एंटीबॉण्डिंग कक्षकों में पाया जाना दर्शाता है कि नाइट्रोजन के मुकाबले ऑक्सीजन ज़्यादा क्रियाशील होगी।
आणविक कक्षक सिद्धांत और वेलेंस बॉण्ड सिद्धांत द्वारा निर्मित मॉडल्स में फर्क यह है कि वेलेंस बॉण्ड मॉडल से लगता है कि नाइट्रोजन अधिक क्रियाशील होगी। इसके अलावा वेलेंस बॉण्ड सिद्धांत के मुताबिक ऑक्सीजन अणु के प्रत्येक ऑक्सीजन परमाणु के पास स्वतंत्र इलेक्ट्रॉन जोड़ी होगी। दूसरी ओर, आणविक कक्षक सिद्धांत के अनुसार पूरे ऑक्सीजन अणु के पास दो अकेले-अकेले इलेक्ट्रॉन होंगे। ऑक्सीजन पर अकेले इलेक्ट्रॉन की उपस्थिति सिद्ध हो चुकी है। ऑक्सीजन के कई गुण इन्हीं अकेले इलेक्ट्रॉन्स के कारण हैं। उन गुणों की बात अभी नहीं करेंगे।
लिहाज़ा आणविक कक्षक सिद्धांत यह व्याख्या कर पाता है कि नाइट्रोजन का अणु इतना स्थिर क्यों है और क्यों हमारे वायुमंडल का तीन-चौथाई भाग नाइट्रोजन से बना है। अलबत्ता नाइट्रोजन का अनुपात इतना अधिक होने का एक कारण यह भी है कि पृथ्वी पर जीवन मौजूद है और पेड़-पौधे अधिकांश कार्बन डाईऑक्साइड का उपयोग प्रकाश संश्लेषण में कर डालते हैं। शुक्र और मंगल जैसे निर्जीव ग्रहों पर वायुमंडल में लगभग 95 प्रतिशत भाग कार्बन डाईऑक्साइड है जबकि नाइट्रोजन मात्र 3 प्रतिशत ही है।
हमने देखा था कि नाइट्रोजन सजीवों के शरीर का एक महत्वपूर्ण तत्व है। सजीवों के शरीर में कई यौगिकों में नाइट्रोजन का पाया जाना इस बात का प्रमाण है कि जीवधारी वायुमंडल की नाइट्रोजन को काफी सुगमता से स्थिर कर लेते हैं यानी उसके यौगिक बना लेते हैं। नाइट्रोजन के इस अक्रिय अणु को जीवधारी कैसे अंगीकार कर लेते हैं, यही लेख के अगले हिस्से का सवाल है।
उमा सुधीर: एकलव्य के विज्ञान शिक्षण कार्यक्रम से संबद्ध हैं। इंदौर में रहती हैं।
अनुवाद एवं संपादन: सुशील जोशी: एकलव्य द्वारा प्रकाशित स्रोत फीचर सेवा से जुड़े हैं।

