सुशील जोशी
 परमाणु भार पढ़ना कितना आसान लगता है न आज। लेकिन रसायनज्ञों के लिए इतना आसान नहीं रहा रास्ता परमाणु भार निकालने का। पचास साल से भी जयादा लगे इस उलझन को सुलझाने में।
परमाणु भार पढ़ना कितना आसान लगता है न आज। लेकिन रसायनज्ञों के लिए इतना आसान नहीं रहा रास्ता परमाणु भार निकालने का। पचास साल से भी जयादा लगे इस उलझन को सुलझाने में।
पानी का सूत्र (H2O) या खड़िया का सूत्र (CaCo3) लिखते हुए क्या आपने कभी सोचा है कि हमें ये सूत्र पता कैसे चले? मसलन पानी को H2O की बजाय HO या H2O या H2O2 क्यों नहीं लिख देते? आखिर रसायन शास्त्री इस बात पर सहमत कैसे हुए कि पानी का रासायनिक सूत्र H2O ही लिखा जाएगा?
 इसी सवाल को दूसरी तरह से निम्नानुसार रखा जा सकता है कि हम कैसे जानते हैं कि पानी के एक अणु में हाइड्रोजन के दो परमाणु तथा ऑक्सीजन का एक परमाणु होता है? आखिर जब हाइड्रोजन और ऑक्सीजन की परस्पर क्रिया होती है और पानी बनता है तो किसी ने बैठकर परमाणुओं की गिनती तो की नहीं है। और उनकी गिनती करना संभव भी नहीं है। रासायनिक क्रियाओं के दौरान जिस चीज़ का मापन होता है, वह है क्रिया करने वाले पदार्थो तथा परिणामी पदार्थों का मापन होता है, वह है क्रिया करने वाले पदार्थ तथा परिणामी पदार्थों की कुल मात्रा। अर्थात 8 ग्राम ऑक्सीजन अ 1 ग्राह हाइड्रोजन उ 9 ग्राम पानी। तो इस जानकारी से यह कैसे समझाया गया कि पानी क्त2ग्र् ही है। दरअसल रसायनशास्त्र की इस महत्वपूर्ण समस्या को सुलझाने में जॉन डाल्टन की भूमिका प्रमुख रही।
इसी सवाल को दूसरी तरह से निम्नानुसार रखा जा सकता है कि हम कैसे जानते हैं कि पानी के एक अणु में हाइड्रोजन के दो परमाणु तथा ऑक्सीजन का एक परमाणु होता है? आखिर जब हाइड्रोजन और ऑक्सीजन की परस्पर क्रिया होती है और पानी बनता है तो किसी ने बैठकर परमाणुओं की गिनती तो की नहीं है। और उनकी गिनती करना संभव भी नहीं है। रासायनिक क्रियाओं के दौरान जिस चीज़ का मापन होता है, वह है क्रिया करने वाले पदार्थो तथा परिणामी पदार्थों का मापन होता है, वह है क्रिया करने वाले पदार्थ तथा परिणामी पदार्थों की कुल मात्रा। अर्थात 8 ग्राम ऑक्सीजन अ 1 ग्राह हाइड्रोजन उ 9 ग्राम पानी। तो इस जानकारी से यह कैसे समझाया गया कि पानी क्त2ग्र् ही है। दरअसल रसायनशास्त्र की इस महत्वपूर्ण समस्या को सुलझाने में जॉन डाल्टन की भूमिका प्रमुख रही।
हिसाब गैसों के वज़न से
डाल्टन का मत था कि प्रकृति एक सरल शै है। इसलिए यदि तत्व परस्पर क्रिया करेंगे तो एक-एक के सरल अनुपात में करेंगे। यानी हाइड्रोजन का एक परमाणु ऑक्सीजन के एक परमाणु से संयोग करेगा और चूंकी 1 ग्राम हाइड्रोजन, 8 ग्राम ऑक्सीजन से मिलकर 9 ग्राम पानी बनाती है इसलिए 1 ग्राम हाइड्रोजन में ठीक उतने ही परमाणु होंगे जितने कि 8 ग्राम ऑक्सीजन में हैं। इसके आधार पर डाल्टन ने कहा कि ऑक्सीजन का एक परमाणु से 8 गुना भारी होगा।।
चूंकि हाइड्रोजन सबसे हल्का तत्व था इसलिए डाल्टन ने उसका भार एक इकाई माना। इस पैमाने पर ऑक्सीज का परमाणु भार 8 हुआ तथा अन्य तत्वों के परमाणु भार भी इसी पैमाने व सरलता की दलील के आधार पर निकालकर डाल्टन ने परमाणु भारों की एक तालिका प्रकाशित की थी।
हिसाब गैसों के आयतन से
डाल्टन ने मूलत: वजन के अनुपातों के आधार पर रासायनिक सूत्र बनाए थे। उसके अनुसार पानी का सूत्र क्तग्र् ही था। परन्तु मात्रा नापने का एक और तरीका हो सकता है। वह तरीका है आयतन नापने का। गैसीय पदार्थों की क्रिया के दौरान आयतन संबंधी मापन के प्रयोग गैलुसेक ने किए। उसने पाया कि गैसों की परसपर क्रिया आयतन के सरल अनुपात में होती है। उदाहरण के लिए 2 लीटर हाइड्रोजन व 1 लीटर ऑक्सीजन परस्पर क्रिया करके 2 लीटर जलवाष्प बनाते हैं। उनके आयतनों का अनुपात 2:1:2 हुआ। गौरतलब है कि आयतनों की तुलना करने के लिए सभी आयतन समान तापमान व दबाव पर नापना ज़रूरी है।
*परन्तु यदि हम यह मानें, जो सही भी है, कि हाइड्रोजन के दो परमाणु ऑक्सीजन के एक परमाणु से संयोग करते हैं, तो ऑक्सीजन का एक परमाणु हाइड्रोजन से 16 गुना भारी होगा क्योंकि तब 1 ग्राम हाइड्रोजन में उपस्थित हाइड्रोजन के परमाणुओं की संख्या 8 ग्राम ऑक्सीजन में उपस्थित परमाणुओं की संख्या से दुगनी होगी।
 डाल्टन का सरलता का तर्क
डाल्टन का सरलता का तर्क
डाल्टन का सरलता का तर्क वास्तव में मात्र सरलता का तर्क नहीं था। उस समय रासायनिक संयोग के लिए कारण तत्वों पर मौजूद आवेश को ज़िम्मेदार माना जाता था। यानी यह माना जाता था कि एक तत्व पर धनावेश तथा दूसरे पर ऋणावेश होने पर वे आपस में क्रिया करते हैं। चूंकि अलग-अलग तत्वों के एक-एक परमाणुओं की आपस में क्रिया हो जाने पर ये आवेश उदासीन हो जाएंगे इसलिए उनके साथ और परमाणुओं के जुड़ाव का कोई कारण नहीं है।
दरअसल डाल्टन ने कहा कि जब दो तत्वों का एक ही यौगिक ज्ञात हो तो माना जाना चाहिए कि उसमें तत्वों के एक-एक परमाणु ही जुड़े हैं। यदि कोई दो तत्व आपस में जुड़कर एकाधिकार यौगिक बनाएं तो उनके रासायनिक सूत्र आनुपातिक आधार पर निकाले जाने चाहिए। जैसा कि हम आज जानते हैं डाल्टन का यह तर्क गलत था।
गैलुसेक ने स्वयं इन प्रयोगों के आधार पर कोई निष्कर्ष नहीं निकाला मगर निष्कर्ष तो साफ था। जब पदार्थ परमाणुओं के रूप में क्रिया करते हैं और आयतनों में सरल अनुपात है तो परमाणु व आयतन का कुछ संबंध होना ही चाहिए यह स्पष्ट था। इस तर्क के आधार पर बर्ज़ीलियस ने मत व्यक्त किया कि या गैसों के बराबर आयतनों में परमाणुओं की संख्या बराबर होगी या इस संख्या का कोई सरल गुणज होगी। जैसे पानी को लें:
हाइड्रोजन + ऑक्सीजन → पानी
2 आयतन + 1 आयतन → 2 आयतन
2n कण + 1 n कण → 2n कण
एक इकाई आयतन में कणों की संख्या n है। जैसे यदि हम एक आयतन में कणों की संख्या n = 10 माल लें तो बर्ज़ीलियस के तर्क का निष्कर्ष यह होगा कि हाइड्रोजन के 2 इकाई आयतन में 20 कण होंगे और ऑक्सीजन के एक इकाई आयतन में 10 कण होंगे। अर्थात बर्ज़ीलियस के अनुसार पानी में हाइड्रोजन व ऑक्सीजन के परमाणुओं की संख्या का अनुपात 2:1 होगा। लिहाज़ा पानी का सूत्र H2O होगा।
 परमाणु भार
परमाणु भार
एक बात ध्यान देने योग्य है। चाहे डाल्टन हो या बर्ज़ीलियस, सब परमाणु भारों की गणना तुलनात्मक रूप से ही करते थे। इसलिए ये सारे परमाणु भार (और आज भी हम जिन परमाणु भारों का इस्तेमाल करते हैं) मूलत: तुलनात्मक परमाणु भार हैं। डाल्टन ने हाइड्रोजन को एक मानकर सारी गणनाएं की थीं। बर्ज़ीलियस ने ऑक्सीजन को 100 मानकर सभी तत्वों के परमाणु भार निकाले। आज हम जिन परमाणु भारों का इस्तेमाल करते हैं वे कार्बन के एक विशेष आइसोटोप को मानक मानकर निकाले गए हैं।
डाल्टन को इस तर्क व निष्कर्ष से घोर आपत्ति थी। प्रमुख आपत्ति यह थी कि इसके अनुसार यदि पानी का एक परमाणु बनाना हो तो ऑक्सीजन के परमाणु के टुकड़े करने होंगे।
हाइड्रोजन ऑक्सीजन पानी
2 आयतन + 1 आयतन 2 आयतन
2 परमाणु + 1 परमाणु 2 परमाणु
1 परमाणु + 1/2 परमाणु 1 परमाणु
यह निष्कर्ष डाल्टन के परमाणु सिद्धांत के विपरीत था1 जिसके अनुसार परमाणु पदार्थ की सबसे छोटी इकाई थी और उसे छोटे टुकड़ों में तोड़ा नहीं जा सकता था।
बहरहाल बर्ज़ीलियस ने अपने तरीके का उपयोग करने हुए कई तत्वों के परमाणु-भारों की गणना करके एक ऐसी तालिका छापी जो डाल्टन की तालिका से काफी भिन्न थी।
परमाणु भार का अखाड़ा
बस अब क्या था बर्ज़ीलियस की देखा-देखी कई सारे लोगों ने अन्य तरीकों का इस्तेमाल करके परमाणु भार व रासायनिक सूत्र निकालना शुरू कर दिया। परिणाम यह हुआ कि अफरातफरी-सी मच गई। परमाणु भार निकालने के तरीके अलग-अलग होते ओर मानक अलग-अलग होते थे। सूत्र एक दूसरे से मेल नहीं खाते। मसलन, बताते हैं कि एसिटिक एसिड जैसे सरल पदार्थ के 13 अलग-अलग सूत्र निकल आए थे!
धीरे-धीरे मात्र परमाणु भार पर आधारित शोध-पत्रों को पढ़ पाना दुभर हो गया। सबके अपने-अपने निजी परमाणु भार होते थे। ऐसी स्थिति में कई लोगों ने परमाणु भार का उपयोग ही बंद कर दिया। अधिकतर लोग तो मात्र संयोजी भार का उपयोग करने लगे। संयोजी भार मतलब किसी एक पदार्थ की जितनी मात्रा दूसरे पदार्थ की किसी निश्चित मात्रा से संयोग करे। जैसे पानी में ऑक्सीजन का संयोजी भार 8 ग्राम है तथा हाइड्रोजन का संयोजी भार 1 ग्राम है।
परमाणु पर संदेह
परमाणु भार की अफरा-तफरी के चलते हालात इतने बुरे हो गए कि कई लोग परमाणु के अस्तित्व पर ही संदेह करने लगे। परमाणु के अस्तित्व पर सवाल या अविश्वास तो डाल्टन के जीवनकाल में ही शुरू हो चुका था। मसलन 1826 में जब डाल्टन को रॉयल सोसायटी का स्वर्ण पदक दिया गया तब सोसायटी के तत्कालीन अध्यक्ष हम्फ्री डेबी ने स्पष्ट शब्दों में कहा था कि यह पदक स्थिर अनुपात के नियम की खोज के लिए दिया जा रहा है। जिसे आमतौर पर परमाणु सिद्धांत कहा जाता है।
ध्यान दें कि रॉयल काफी सावधानी बरतती थी।
दूसरी तरफ एक अन्य रसायनज्ञ ड् यूमास ने गैसों की परस्पर क्रिया के अजीबो-गरीब परिमाणों से त्रस्त होकर कहा था “यदि मेरा बस चलता तो मैं विज्ञान से परमाणु का नामोनिशान मिटा देता।” कार्बनिक रसायन फ्रेडरिक व्होलर का मत था कि “इस सबकी वजह से कार्बनिक रसायन किसी को भी पागलग बना देने के लिए काफी है।”
यानी कुल मिलाकर स्थिति यह थी कि यदि परमाणु भार की गुत्थी न सुलझती तो शायद परमाणु अपने ही भार तले दबकर खत्म हो जाता!
आश्चर्य की बात यह है कि अफरा-तफरी के इस पूरे दौर में किसी का भी ध्यान अमीदियों बवोगेड्रो के विचारों की ओर नहीं गया जो ‘जर्नल द फिज़ीक’ के चार पन्नों में सिमटे पड़े थे। और अन चार पन्नों में पूरी समस्या का हल मौजूद था। यों कह सकते है कि एवोगेड्रो के विचारों के लिए जिस माहौल की ज़रूरत थी वह तैयार हो रहा था।
 बहरहाल त्रस्त रसायनज्ञों में से एक थे ऑगस्ट केकुले। जी हां, वही केकुले जिन्हें हम आमतौर पर बेंज़ीन की रचना के मामले में जानते हैं। केकुले ने एक सकारात्मक पहल की जो विज्ञान के इतिहास में अभूतपूर्व थी। उन्होंने दुनिया भर के रसायनज्ञों का एक सम्मेलन बुलाया। इस सम्मेलन का मकसद था - परमाणु भार को लेकर मचे अखाड़े का कुछ सर्वमान्य हल निकालना।
बहरहाल त्रस्त रसायनज्ञों में से एक थे ऑगस्ट केकुले। जी हां, वही केकुले जिन्हें हम आमतौर पर बेंज़ीन की रचना के मामले में जानते हैं। केकुले ने एक सकारात्मक पहल की जो विज्ञान के इतिहास में अभूतपूर्व थी। उन्होंने दुनिया भर के रसायनज्ञों का एक सम्मेलन बुलाया। इस सम्मेलन का मकसद था - परमाणु भार को लेकर मचे अखाड़े का कुछ सर्वमान्य हल निकालना।
वैज्ञानिकों का यह प्रथम सम्मेलन जर्मनी के कार्लरुाुहे नाम के स्थान पर 1860 में हुआ। यदि इस सम्मेलन में कैनिज़रों नामक अध्यापक मौजूद न होता, तो शायद परमाणुवाद का जनाज़ा निकल ही गया होता।
कैनिज़रों प्रतिक्रिया के संदर्भ में जानते हैं। मगर रसायनशास्त्र में शायद उसका सबसे महत्वपूर्ण योगदान यह था कि उसने सम्मेलन में मौजूद रसायनज्ञों का ध्यान एवोगेड्रो के उस परचे की ओर दिलाया जो उस सम्मेलन से लगभग 50 साल पहले 1811 में लिखा था। सम्मेलन में कैनिज़रों ने बताया कि एवोगेड्रो के तरीके से इस समस्या का समाधान तुरंत हो सकता है। सवाल उठता है कि आखिर वह जादुई विधि क्या थी?
अणु परमाणु भेद
 एवोगेड्रो के विचारों में दो बातें गौरतलब हैं। पहली बात तो यह कि एवोगेड्रो के विचार किसी सैद्धांतिक समझ से नहीं उभरे थे। गैलुसेक के प्रयोग और डाल्टन के परमाणु सिद्धांत के बीच एक व्यवहारिक तालमेल बैठाने के लिए ही अणु (एकाधिकार परमाणुओं से मिलकर बने कण) की अवधारणा प्रस्तुत की गई थी।
एवोगेड्रो के विचारों में दो बातें गौरतलब हैं। पहली बात तो यह कि एवोगेड्रो के विचार किसी सैद्धांतिक समझ से नहीं उभरे थे। गैलुसेक के प्रयोग और डाल्टन के परमाणु सिद्धांत के बीच एक व्यवहारिक तालमेल बैठाने के लिए ही अणु (एकाधिकार परमाणुओं से मिलकर बने कण) की अवधारणा प्रस्तुत की गई थी।
दूसरी बात यह है कि एवोगेड्रो का परचा प्रकाशित होने के समय यह माना जाता था कि तत्वों के बीच रासायनिक क्रिया तभी होती है जब उन पर विपरीत आवेश मौजूद हो। लिहाज़ा यह स्वीकार करना काफी मुश्किल था कि एक ही तत्व के दो या अधिक परमाणु आपस में क्रिया करेंगे, जबकि उन पर समान आवेश है। 1860 में रासायनिक क्रिया का यह आवेश आधारित सिद्धांत कमज़ोर पड़ने लगा था। ऐसे समय में एवोगेड्रो के विचारों को आसानी से मंजूरी मिल गई। मगर सबसे बड़ी बात यह थी कि अफरा-तफरी से निजात पाने का यह एक व्यवहारिक तरीका था।
एवोगेड्रो का निदान
1811 के परचे में एवोगेड्रो ने मूलत: यह स्पष्ट किया कि पदार्थ के सबसे छोटे कण दो प्रकार के होते हैं। एक होते हे परमाणु और दूसरे अणु। हालांकि एवोगेड्रो ने पूरी बात को काफी जटिल ढंग से पेश किया था मगर सार यह था कि अणु का मतलब है एकाधिकार परमाणुओं से मिलकर बने कण। सबसे बड़ी बात यह थी कि एवोगेड्रो ने तत्वों के अणु की भी बात की थी। उनका मत था कि कई तत्व परमाणुओं के रूप में नहीं बल्कि अणुओं के रूप में रहते हैं एवोगेड्रो ने यह भी बताया कि गैसों के बराबर आयतन में अणुओं की संख्या बराबर होती है।
इस तरह एवोगेड्रो ने अणु-परमाणु का भेद करके पूरी समस्या का एक हल दिया था। एवोगेड्रो के मुताबिक हाइड्रोजन व ऑक्सीजन की क्रिया कुछ इस तरह समझी जा सकती है:
हाइड्राजन + ऑक्सीजन → पानी
2 आयतन + 1 आयतन → 2 आयतन
2n अणु + 1n अणु → 1n अणु
1 अणु + 1/2 अणु 1 अणु
अर्थात एवोगेड्रो का मत था कि गैसों के बराबर अणुओं की संख्या बराबर होती है। अणुओं को विभाजित करना डाल्टन के सिद्धांत के विरूद्ध नहीं था क्योंकि एक अणु में एक से अधिक परमाणु हो सकते हैं। जैसे कि हाइड्रोजन के एक अणु में (H2) दो परमाणु हैं या ऑक्सीजन के एक अणु में (O2) दो परमाणु हैं।
एक बार यह तय हो जाने पर कि सभी गैसों के बराबर आयतन में अणुओं की संख्या बराबर है, बात आसान हो जाती है। इसके आधार पर कैनिज़रो ने जो विधि सुझाई वह यहां बाक्स में दी गई है। वैसे आप स्वयं भी ज़रा अपने अक्ल के घोड़ों की लगाम ढीली छोड़ें तो समझ पाएंगे कि यह काम कैसे हो सकता है।
सुशील जोशी - पर्यावरण, विज्ञान विषयों पर सतत लेखन। होशंगाबाद विज्ञान शिक्षण कार्यक्रम से संबद्ध।
कैनिज़रों विधि
1. एवोगेड्रो के मुताबिक पानी का सूत्र H2O आता है।
2. यदि समस्त गैसों के बराबर आयतन में बराबर संख्या में अणु हैं तो गैसों का अणु भार उनके घनत्व के समानुपाती होगा।
M = D या M = K D,
M = अणु भार, D = घनत्व K = समानुपात स्थिरांक
3. अगर किसी गैस का अणुभार मालूम है तो उसका घनत्व निकालकर, स्थिरांक की गणना की जा सकती है। हाइड्रोजन व ऑक्सीजन का उदाहरण लेकर देखते हैं। हाइड्रोजन का परमाणु भार 1.0 है। इसका अणु दो परमाणुओं से मिलकर बना है। अत: हाइड्रोजन का अणु भार 2 हुआ।
ऑक्सीजन का परमाणु भार 16 है और यह भी दो परमाणुओं से मिलकर एक अणु बनाती है। अत: ऑक्सीजन का अणु भार 32 हुआ।
4. इन आंकड़ों के आधार पर की ख़् गणना:

5. अब मान लीजिए कार्बन व क्लोरीन का परमाणु भार पता करना है। इन तत्वों के विभिन् न गैसीय यौगिकों के आंकड़े लेकर निम्नानुसार विश्लेषण करना होगा:
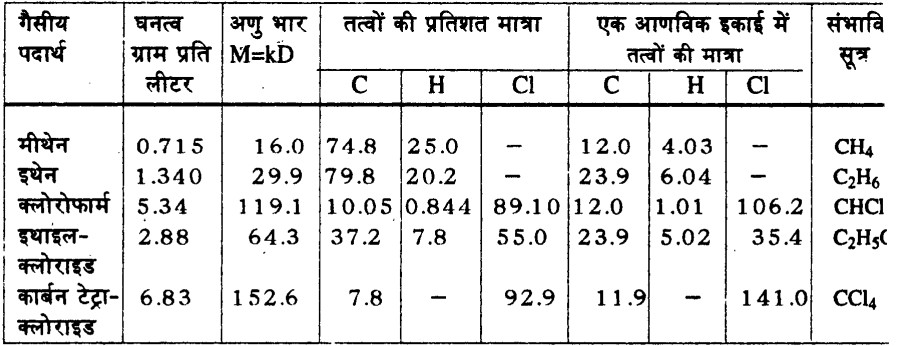
6. स्तंभों को शुरुआत से एक-एक करके देखते हैं।
किसी भी गैस का घनत्व तो प्रयोगों से पता किया ही जा सकता है। (स्तंभ-1) स्थिरांक का मान निकाल लिया है और घनत्व मालूम है, इन दोनों से अणुभार की गणना की जा सकती है। (स्तंभ-2)
प्रयोगों द्वारा गैस में तत्वों की प्रतिशत मात्रा पता लगाई जा सकती है। (स्तंभ-3, 4, 5)
7. एक आणविक इकाई में तत्व का अनुपात पता करने का तरीका मीथेन के उदाहरण से देखते हैं।
100 इकाई मीथेन में कार्बन की मात्रा = 74.8
16 इकाई मीथेन (अणु भार) में कार्बन की मात्रा = 74.8 x 16 / 100
= 12.0
100 इकाई मीथेन में हाइड्रोजन की मात्रा = 25.0
16 इकाई मीथेन में हाइड्रोजन की मात्रा = 25.0 x 16 / 100
= 4.0
8. इसी तरह अन्य गैसों के लिए भी उनमें मौजूद तत्वों की मात्रा निकाल ली जाती है। अब यह देखा जाता है कि विभिन्न गैसों की एक आणविक इकाई में उपस्थित तत्वों की मात्रा का अधिकतम समापत्वर्य (Highest Common Factor) क्या है।
मसलन उपरोक्त उदाहरण में विभिन्न यौगिकों में कार्बन की मात्राओं का अधिकतम समापवत्र्य 12 है। अर्थात किसी भी यौगिक की एक आणविक इकाई में कार्बन इससे कम नहीं पाया जाता। यानी यही कार्बन की सबसे छोटी इकाई मानी जा सकती है। लिहज़ा कार्बन का परमाणु भार 12 माना जा सकता है।
यदि कोई यौगिक ऐसा मिलता है जिसमें कार्बन की मात्रा 6 पाई जाए तो फिर हमें कार्बन का परमाणु भार संशोधित करना होगा और उसी के अनुसार उपरोक्त तालिका में दिए गए रासायनिक सूत्र भी संशोधित होंगे। तब तक के लिए कार्बन का परमाणु भार 12 मानना ही युक्तिसंगत होगा।
इसी तरह से अन्य तत्वों के परमाणु भार भी निकाले जा सकते हैं।
सुशील जोशी
डाल्टन का सरलता का तर्क
दरअसल डाल्टन ने कहा कि जब दो तत्वों का एक ही यौगिक ज्ञात हो तो माना चाहिए कि उसमें तत्वों के एक-एक परमाणु ही जुड़े हैं। यदि कोई दो तत्व आपस में जुड़कर एकाधिकार यौगिक बनाएं तो उनके रासायनिक सूत्र आनुपातिक आधार पर निकाले जाने चाहिए। जबकि इस तरह से निकाले गए कई सूत्र सही थे परन्तु जैसा कि हम आज जानते हैं डाल्टन का यह तर्क गलत था।
 नाइट्रस गैस (नाइट्रिक ऑक्साइड)
नाइट्रस गैस (नाइट्रिक ऑक्साइड)
नाइट्रिक ऑक्साइड
नाइट्रिक अम्ल (नाइट्रोजन डाइऑक्साइड)
कार्बोनिक ऑक्साइड (कार्बन मोनोऑक्साइड)
कार्बोनिक अम्ल (कार्बन डाइऑक्साइड)
पानी

