अजय शर्मा
 विज्ञान में भी कई भ्रामक मान्यताएं जगह बना लेती हैं जिन्हें कभी-न-कभी चुनौतियों का सामना करना ही पड़ता है। उष्मा का कैलोरिक सिद्धांत भी एक ऐसा ही सिद्धांत था जिसे चुनौती मिली एक शाही तोपखाने से। क्यों और कैसे - पढ़िए इस लेख में।
विज्ञान में भी कई भ्रामक मान्यताएं जगह बना लेती हैं जिन्हें कभी-न-कभी चुनौतियों का सामना करना ही पड़ता है। उष्मा का कैलोरिक सिद्धांत भी एक ऐसा ही सिद्धांत था जिसे चुनौती मिली एक शाही तोपखाने से। क्यों और कैसे - पढ़िए इस लेख में।
उष्मा (यानी गर्मी) और उससे जुड़े तथ्यों के बारे में अटकलें लगाना वैज्ञानिकों का खासा शगल रहा है। इन वैज्ञानिकों की लम्बी फेहरिस्त में एक नाम काउंट रमफोर्ड का भी है। रमफोर्ड (1753 - 1814) एक दिलचस्प शख्सियत के मालिक थे। अपने ज़माने में उनका यूरोप में एक जाने-माने वैज्ञानिक और कुशल युद्ध विशेषज्ञ के रूप में खासा दबदबा हुआ करता था। उनकी बहुआयामी प्रतिभा को देखते हुए बरतानिया सरकार ने उन्हें एक महत्वपूर्ण काम सौंप रखा था। यह काम था शाही फौज के लिए अपनी देखरेख में तोपों की नलियों में सुराख करवाना।
इस काम के लिए खास किस्म की मशीन का इस्तेमाल किया जाता था। इस मशीन में विशेष किस्म के धातु काटने वाले संयत्र लगे हुए थे जो ठोस इस्पात को काटते हुए तोपों की नलियों में आर-पार, एक सही नाप का छेद कर दिया करते थे। इस खास किस्म के कटर्स को अश्व-शक्ति से घुमाया जाता था। इस काम को करने वाले लोग भी जानते थे कि तोपों में छेद करते समय नली जल्दी ही गर्म हो जाती है। इस काम में इतनी गर्मी पैदा होना एक साधारण-सी बात मानी जाती थी; तोपखाने में काम करने वालों के लिए भी और वैज्ञानिकों के लिए भी।
हरेक चीज़ कैलोरिक से भरी
दरअसल उन दिनों विज्ञान-जगत में उष्मा की प्रकृति को लेकर एक मत काफी जोर-शोर से छाया हुआ था; वह था ‘कैलोरिक का सिद्धांत’। इसके हिसाब से तोपों में छेद करते समय अत्याधिक गर्मी पैदा होने का एक सरल-सा कारण था - इस सिद्धांत के मुताबिक यह माना जाता था कि उष्मा दरअसल कैलोरिक नाम का द्रव्यमान रहित तरल पदार्थ हे जो हरेक वस्तु में उसके तापमान के अनुपात में मौजूद रहता है। यानी तोपों की नलियों में भी कैलोरिक भरी होती है। अब जिस तरह किसी फल को काटने पर उसमें से रस टपकने लगता है लगभग उसी तरह तोपों में छेद करने पर उसमें से कैलोरिक का रिसाव होने लगता है और नली गर्म हो जाती है।
इस विश्लेषण से अधिकांश वैज्ञानिक संतुष्ट थे लेकिन रमफोर्ड को यह बात ज़रा भी नहीं जंची। तोपखाने के अपने अनुभवों की वजह से उन्हें लगा कि असल माजरा कुछ और ही है। साथ-ही-साथ उन्हें कैलोरिक सिद्धांत की प्रामाणिकता पर भी शक होने लगा। लिहाज़ा रमफोर्ड ने अपने तोपखाने को ही प्रयोगशाला बनाकर कई प्रयोग किए और इस नतीजे पर पहुंचे कि कैलोरिक सिद्धांत सही नहीं है।
इन प्रयोगों से कैलोरिक सिद्धांत को ऐसा करारा झटका लगा कि वह फिर कभी उबर नहीं पाया और उष्मा के बारे में हमारी समझ को आखिरकार एक दिशा मिली। तोपखाने को जन्मे प्रश्न उष्मा जैसी महत्वपूर्ण वास्तविकता को समझने के लिए कितने अनमोल साबित हुए यह अब एक सुखद आश्चर्य की बात ही लगती है। हालांकि एक समग्र दृष्टिकोण से देखा जाए तो विज्ञान के इतिहास में ऐसी घटनाएं अनेक बार घटी हैं। आखिर आर्किमीडीज़ को अपना उत्प्लावद का सिद्धांत गुसलखाने में तो सूझा था।
गर्मी के मायने
वैसे यह भी एक दिलचस्प इत्तफाक ही है कि हालांकि गर्मी की अनुभूति हमारे दैनिक अनुभवों का एक अनिवार्य अंग है, पर गर्मी आखिर क्या ‘चीज़’ है यह सवाल आम आदमी के लिए हमेशा उलझन भरा रहा है। करीब 125 साल पहले तक तो वैज्ञानिकों में भी इस सवाल को लेकर काफी मतभेद थे। इन मतभेदों को दूर करने के लिए कई चोटी के वैज्ञानिकों को कई साल तक जद्दो-जहद करनी पड़ी और तब कहीं जाकर मामला साफ हुआ। इस लेख में हम इसी सवाल पर चर्चा करके उष्मा के बारे में एक सही शुरुआती समझ विकसित करने की कोशिश करेंगे। लेकिन इससे पहले कि गर्मजोशी से गर्मी की जांच-पड़ताल शुरू करें, क्यों न रमफोर्ड वाला किस्सा पूरा ही कर लिया जाए?
 रमफोर्ड ने तोड़ी खुशफहमी
रमफोर्ड ने तोड़ी खुशफहमी
अब जैसा हमने पहले ज़िक्र किया था रमफोर्ड ने कैलोरिक सिद्धांत को परखने के लिए कई प्रयोग किए और उन्होंने पाया कि मात्र घर्षण द्वारा भी किसी भी धातु से, बिना उसमें बदलाव लाए, ढेर सारी गर्मी पैदा की जा सकती है। इस तरह गर्मी पैदा करने से धातु के द्रव्यमान पर कोई असर नहीं पड़ता। तोपों की नलियों में सुराख करते वक्त गर्मी पैदा होने बारे में उनका निष्कर्ष था कि इस गर्मी का असली रुाोत उन घोड़ों की ऊर्जा है जिनकी शक्ति से सुराख करने वाला यंत्र चलता है। यानी घोड़ों की ताकत ही घर्षण द्वारा गर्मी में परिवर्तित हो जाती है। सन् 1798 में लिखे एक यादगार पर्चे में उन्होंने दावा किया कि उष्मा कोई पदार्थ नहीं हो सकती बल्कि उष्मा का गहन संबंध तो पदार्थो में अवतरित होने वाली ‘माइक्रोस्कोपिक’ गतियों से होना चाहिए।
दरअसल, रमफोर्ड पहले वैज्ञानिक नहीं थे जिन्होंने उष्मा को सूक्ष्म गतियों से जुड़ा पाया। 17वीं और 18वीं सदी में प्राय: सभी वैज्ञानिकों के मत इसी तरह के थे। मसलन न्यूटन भी इसी तरह के विचार रखते थे। फिर भी जिस वक्त रमफोर्ड अपने प्रयोग कर रहे थे कैलोरिक सिद्धांत धीर-धीरे विज्ञान जगत में अपनी पकड़ मज़बूत कर चुका था। यह शायद इसलिए कि उन दिनों रसायन विज्ञान में नित दिन नई-नई खोजें हो रही थीं और इन खोजों को समझाने में कैलोरिक सिद्धांत काफी उपयोगी साबित हो रहा था। एक कारण यह भी है कि रमफोर्ड से पहले उष्मा को ‘माइक्रोस्कोपिक’ गतियों की अभिव्यक्ति के रूप में देखना महज एक आकर्षक और प्रभावशाली विचार था, प्रयोगों की कसौटी पर खरा उतरा सिद्धांत नहीं।
अब मज़े की बात यह थी कि रमफोर्ड का निशाना सही था फिर भी उनके शिकार ने उसकी चोट से दम नहीं तोड़ा। सन् 1798 के करीब 50 साल बाद भी कोई-न-कोई वैज्ञानिक गुट कैलोरिक सिद्धांत का हिमायती बना रहा। बहरहाल उसमें कोई शक नहीं कि रमफोर्ड के प्रयोगों के बाद कैलोरिक सिद्धांत की प्रतिष्ठा में निरंतर ह्यास होता गया और एक बार फिर उष्मा को पदार्थो में होने वाली सूक्ष्म गतियों से जुड़ा हुआ देखने की परंपरा बलवती होती गई।
रमफोर्ड के प्रयोगों के कारण कब्रा से उठ खड़ी हुई इस अवधारणा को एक ठोस नींव प्रदान की जूल और मेयर के प्रयोगों ने। सन् 1840-50 के दौरान किए गए इन प्रयोगों से साफ ज़ाहिर हो गया कि उष्मा वास्तव में ऊर्जा का ही एक रूप है। इसी दौरान कई वैज्ञानिकों (जिनमंे मेक्सवेल का नाम प्रमुख है) के शोध कार्यों ने भी सूक्ष्म गति वाली बात को समझने में मदद की। यही विचार आज भी उष्मा की अवधारणा के केन्द्र बिन्दु के रूप में प्रतिष्ठित है।
कुछ तो ठंडा, कुछ गर्म
चलिए, बहुत हो गया इतिहास के इन गलियारों में घूमला-फिरना, इसके बाद अब शुरू करते हैं कोशिश उष्मा को समझने की, उष्मा को वैज्ञानिक दृष्टिकोण से देखने की। वैसे उष्मा का वैज्ञानिक पहलू जो भी हो एक बात तो सभी स्वीकार करेंगे कि जहां तक अपने दैनिक जीवन का सवाल है, उष्मा से हमारा परिचय एक व्यक्तिगत अनुभूति के रूप में ही होता है। कोई चीज़ हमें ठंडी लगती है तो कोई गर्म। आग के पास खड़े होने पर जब हमारा शरीर गर्म होने लगता है तो हम कहते हैं कि गर्मी हमारे शरीर में प्रवेश कर रही है। या फिर हम देखते हैं कि जलते हुए चूल्हे की गर्मी मिलने पर उस पर रखा हुआ पानी गर्म हो उठता है। हमारे इस तरह के अनुभव हमें इतना तो बताते हैं कि उष्मा कुछ ऐसी चीज़ है तो ज़्यादा तापमान से कम तापमान की ओर बहती है। गर्म वस्तु से ठंडी वस्तु की तरफ या फिर किसी एक पदार्थ के गर्म हिस्से से अपेक्षाकृत ठंडे हिस्से की तरफ। पर आखिर यह चीज़ क्या है इसका सिर्फ एक धुंधला-सा अनुमान ही लग पाता है।
जैसा कि हमने जिक्र किया था हमारे धुंधले अनुमानों को स्पष्टता मिली जूल और मेयर के महत्वपूर्ण प्रयोगों द्वारा। उनकी शोध से यह साबित हो गया कि यह चीज़ वास्तव में एक प्रकार की ऊर्जा ही है। मिसाल के तौर पर हम अपने से गर्म किसी वस्तु को छूते हैं तो वह ऊर्जा ही होती है जो गर्म वस्तु से हमारे हाथ में आ जाती है और हमारा हाथ गर्म हो जाता है। उष्मा हमेशा ज़्यादा तापमान से कम तापमान की ओर बहती है। गर्म वस्तु से ठंडी वस्तु की ओर। इस समझ के आधार पर हम कह सकते हैं कि - तापमान भिन्न होने के कारण दो वस्तुओं के बीच बहने वाली ऊर्जा को उष्मा कहते हैं।
यह एक अनुभव की बात है कि जब किसी गर्म वस्तु को एक ठंडी वस्तु के संपर्क में लाया जाता है तो कुछ समय बाद दोनों चीज़ों का तापमान एक समान हो जाता है। ऐसी स्थिति को वैज्ञानिक ‘उष्मीय संतुलन’ कहते हैं। उष्मीय संतुलन वाला तापमान गर्म वस्तु के तापमान से कम और ठंडी वस्तु के तापमान से ज़्यादा होता है।
हमारी अब तक की चर्चा दैनिक जीवन के अनुभवों पर ही आधारित थी इस चर्चा में हम उष्मा के एक अहम पहलू से वाकिफ हुए हैं। परन्तु अगर हमें एक गहरी समझ बनानी हैं तो उष्मा से जुड़ी प्रक्रियाओं को आणविक स्तर पर समझना लाज़िमी हो सकता है।
जैसा कि आप जानते होंगे सभी पदार्थ अणुओं-परमाणुओं से बने होते हैं। ये कण सतत हिलते-डुलते रहते हैं, कभी भी एक बिन्दु पर स्थिर नहीं रहते। जैसे अगर गैसीय अवस्था की बात करें तो किसी भी गैस में सामान्य दबाव पर अणु-परमाणु बिना किसी बल के प्रभाव में और स्वतंत्रता से पूरे आयतन में (जिसमें गैस मौजूद होती है) इधर-उधर, एक-दूसरे से टकराते हुए विचरते रहते हैं। गैस ऐसे ही स्वतंत्र और गतिशील कणों की बनी हुई होती है। द्रव में अणुओं के बीच एक हल्का आकर्षण बल मौजूद रहता है जिसके कारण वे एक-दूसरे से थोड़े बंधे से रहते हैं लेकिन फिर भी अणु धीमी गतियों से द्रव के पूरे आयतन में घूमते रहते हैं। हां, ठोस पदार्थो में ज़रूर हालात थोड़े जुदा हो जाते हैं। यह इसलिए क्योंकि इनके अणुओं के बीच एक शक्तिशाली आकर्षक बल मौजूद होता है जो पड़ोसी अणुओं को एक-दूसरे से एक Ïस्प्रग की माफिक बांधकर रखता है। यानी हरेक कण अपनी जगह पर बंधकर रह जाता है। लेकिन ये कण स्थिर तो ठोस पदार्थ में भी नहीं रहते, हरेक कण अपने ‘औसत स्थान’ से इधर-उधर हमेशा हिलता-डुलता रहता है। कणों की यह स्थानांतरण चाल (ट्रांसलेशनल मोशन) चाहे वे ठोस, द्रव या गैस के हों, उनको एक गतिज ऊर्जा प्रदान करती है। किसी पदार्थ के सभी कणों की कुल गतिज ऊर्जा को उस पदार्थ की उष्मीय ऊर्जा कहते हैं। ज़ाहिर है कि किसी अणु की गतिज ऊर्जा उसकी स्थानांतर गति पर निर्भर करती है। यानी धीरे हिलने वाले कणों की गतिज ऊर्जा कम और तेज़ी से हिलने वाले कणों की गतिज ऊर्जा ज़्यादा होगी।
कैसे चलती है उष्मा 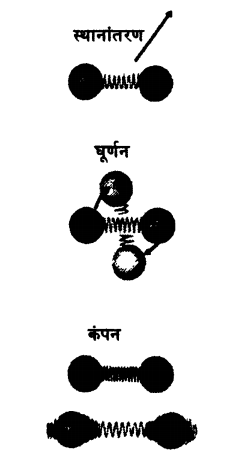 अब जहां तक उन पदार्थो का सवाल है जिनके सबसे छोटे कण परमाणु हैं, अणु नहीं, ऊपर दी गई जानकारी उनकी सूक्ष्मस्तरीय उनकी सूक्ष्मस्तरीय संरचना के बारे में एक सही तस्वीर उभारती है। परन्तु उन पदार्थो में (चाहे वह ठोस, द्रव या गैया हों) जिनके सबसे छोटे कण अणु हैं कुछ नई जटिलताएं उभर आती हैं जिन्हें नज़रअंदाज़ नहीं किया जा सकता। इन जटिलताओं की वजह है अणुओं की अपनी अंदरूनी बनावट। चूंकि अणु खुद परमाणुओं से बने होते हैं, उनमें स्थानांतर चाल के अलावा दो और किस्म की चालें संभव हैं - घूर्णन और कंपन। यानी अणु इधर-उधर घूमते-फिरने या हिलने-डुलने के अलावा कंपन और/या घूर्णन भी करें ऐसी संभावना को नकारा नहीं जा सकता।
अब जहां तक उन पदार्थो का सवाल है जिनके सबसे छोटे कण परमाणु हैं, अणु नहीं, ऊपर दी गई जानकारी उनकी सूक्ष्मस्तरीय उनकी सूक्ष्मस्तरीय संरचना के बारे में एक सही तस्वीर उभारती है। परन्तु उन पदार्थो में (चाहे वह ठोस, द्रव या गैया हों) जिनके सबसे छोटे कण अणु हैं कुछ नई जटिलताएं उभर आती हैं जिन्हें नज़रअंदाज़ नहीं किया जा सकता। इन जटिलताओं की वजह है अणुओं की अपनी अंदरूनी बनावट। चूंकि अणु खुद परमाणुओं से बने होते हैं, उनमें स्थानांतर चाल के अलावा दो और किस्म की चालें संभव हैं - घूर्णन और कंपन। यानी अणु इधर-उधर घूमते-फिरने या हिलने-डुलने के अलावा कंपन और/या घूर्णन भी करें ऐसी संभावना को नकारा नहीं जा सकता।
अब अगर किसी पदार्थ के अणुओं में स्थानांतरण चाल के अलावा घूर्णन और/या कंपन भी हो रहा है तो ज़ाहिर है अणुओं के पास स्थानांतरण चाल से उत्पन्न गतिज ऊर्जा के अलावा कुछ और ऊर्जा भी होगी जिसे अणुओं का कंपन और/या घूर्णन जन्म देता है। इस अतिरिक्त ऊर्जा को हम अणुओं की आंतरिक स्थितिज ऊर्जा कह सकते हैं। ज़ाहिर है कंपन और/या घूर्णन जितना तेज़ होगा, अणु की आंतरिक स्थितिज ऊर्जा भी उतनी ही अधिक होगी। यानी किसी पदार्थ में:
कुल संचित ऊर्जा = अणुओं की कुल गतिज ऊर्जा (उष्मीय उर्जा) + कुल आंतररिक स्थितिज ऊर्जा (अगर है तो)
 इस कुल संचित ऊर्जा को पदार्थ की आंतरिक ऊर्जा (इंटरनल एनर्जी) कहते हैं। उष्मा की, और देखते हैं कि आणविक स्तर पर इस अवधारणा की क्या तस्वीर उभरती है। अभी तक की गई चर्चा के आधार पर यह बखूबी साबित हो जाता है कि किसी वस्तु का तापमान उसके कणों की स्थानांतर गतियों से यानी पदार्थ की उष्मीय ऊर्जा से जुड़ा हुआ है। दूसरे शब्दों में उष्मीय ऊर्जा एक तरह की तापमान को जन्म देती है। यही वजह है कि यह ऊर्जा हमारे जीवन के अनगिनत पहलुओं में शामिल है - भोजन पकाने से अपने शरीर को गर्म रखने तक। जिस वस्तु में जितनी ज़्यादा उष्मीय ऊर्जा होती है उसका तापमान उतना ही अधिक होता है। मिसाल के तौर पर आपने अनुभव किया होगा कि जब हम किसी धातु की वस्तु पर हथोड़े से चोट करते हैं तो वह गर्म हो जाती है। क्या आप बता सकते हैं कि ऐसा क्यों होता है?
इस कुल संचित ऊर्जा को पदार्थ की आंतरिक ऊर्जा (इंटरनल एनर्जी) कहते हैं। उष्मा की, और देखते हैं कि आणविक स्तर पर इस अवधारणा की क्या तस्वीर उभरती है। अभी तक की गई चर्चा के आधार पर यह बखूबी साबित हो जाता है कि किसी वस्तु का तापमान उसके कणों की स्थानांतर गतियों से यानी पदार्थ की उष्मीय ऊर्जा से जुड़ा हुआ है। दूसरे शब्दों में उष्मीय ऊर्जा एक तरह की तापमान को जन्म देती है। यही वजह है कि यह ऊर्जा हमारे जीवन के अनगिनत पहलुओं में शामिल है - भोजन पकाने से अपने शरीर को गर्म रखने तक। जिस वस्तु में जितनी ज़्यादा उष्मीय ऊर्जा होती है उसका तापमान उतना ही अधिक होता है। मिसाल के तौर पर आपने अनुभव किया होगा कि जब हम किसी धातु की वस्तु पर हथोड़े से चोट करते हैं तो वह गर्म हो जाती है। क्या आप बता सकते हैं कि ऐसा क्यों होता है?
दरअसल हथोड़े के प्रहार से धातु के अणु पहले की अपेक्षा ज़्यादा वेग से हिलने लगते हैं। इससे धातु की उष्मीय ऊर्जा बढ़ जाती है। जहां यह सब हो तो भला तापमान कैसे पीछे रह जाए! वह भी देखा-देखी ऊपर चढ़ जाता है। बाद में हथोड़े में चोटों का सिलसिला बंद करने पर धातु के उत्तेजित कण धीरे-धीरे अपनी गतिज ऊर्जा आसपास की हवा (या जिस भी माध्यम में वह वस्तु है) के कणों को स्थानांरित कर देते हैं। इससे खुद उनका हिलना-डुलना धीमा पड़ जाता है और वस्तु फिर से अपने पहले वाले तापमान पर लौट आती है। इसी तरह इसी तरह जब हम अपने से गर्म किसी वस्तु से हाथ से छूते हैं तो उस चीज़ के तेज़ी से हिलते-डुलते कण अपनी कुद गतिज ऊर्जा हमारे हाथ के अणुओं को स्थानांतरित करके उन्हें उत्तेजित कर देते हैं। अर्थात वह गर्म वस्तु अपनी कुछ उष्मीय ऊर्जा उष्मा के माध्यम से हमारे हाथ को पहुंचा देती है और हमारा हाथ भी गर्म हो जाता है।
अब सवाल यह उठता है कि क्या हमारे हाथ को मिलने वाली उष्मा सारी-की-सारी उष्मीय ऊर्जा में परिवर्तित हो जाती है? संभवत: नहीं। वे पदार्थ जिनके सबसे छोटे कण अणु हैं परमाणु नहीं, उनमें ज़रूरी नहीं कि दी जाने वाली सारी उष्मा पदार्थ की अपनी उष्मीय ऊर्जा में परिवर्तित हो। यह भी संभव है कि उष्मा का कुछ ही भाग उष्मीय ऊर्जा में बदले और शेष में परिवर्तित हो जाए। दरअसल, अक्सर ऐसा ही होता है (पर हमेशा नहीं)।
अब दिलचस्प बात यह है कि स्थितिज ऊर्जा पदार्थ का तापमान बढ़ाने में बिलकुल भी योगदान नहीं देती। अर्थात अगर किसी पदार्थ को मिलने वाली सारी की सारी उष्मा उसकी आंतरिक स्थितिज ऊर्जा में परिवर्तित हो जाए तो उस पदार्थ का तापमान लेशमात्र भी न बढ़ेगा। मिसाल के तौर पर, जब कोई पदार्थ एक अवस्था में जाता है जैसे बर्फ पिघलकर पानी बनाती है या पानी उबलकर वाष्प में परिवर्तित हो जाता है, तो इस अंतराल के दौरान पदार्थ को मिलने वाली सम्पूर्ण उष्मा अणुओं की आंतरिक स्थितिज ऊर्जा में ही जुड़ती है। पदार्थ की उष्मीय ऊर्जा ज़रा भी इज़ाफा नहीं होता। यही कारण है कि जब आप बर्फ को गर्म करके पिघला रहे होते हैं तो जब आप बर्फ को गर्म करके पिघला रहे होते हैं तो जब तक पूरी-की-पूरी बर्फ नहीं पिघल जाती बर्फ और पानी के मिश्रण का तापमान ज़रा भी नहीं बढ़ता। वह शून्य डिग्री सेल्सियस पर ही बना रहता है। हां, किसी पदार्थ को उष्मा देने पर इस अपवाद से एकदम उल्टा हो सकता है। यानी यह भी हो सकता है कि सम्पूर्ण उष्मा पदार्थ की उष्मीय ऊर्जा में ही परिवर्तित हो जाए। ऐसा अक्सर बहुत कम तापमान पर ही होता हे। मिसाल के तौर पर हाइड्रोजन गैस/द्रव का तापमान जब तक लगभग - 200 डिग्री सेल्सियस से नीचे रहता है उसको दी जाने वाली उष्मा पूरी की पूरी उष्मीय ऊर्जा यानी अणुओं की औसत स्थानांतर गति में ही परिवर्तित होती है। यहां हम यह मानकर चल रहे हैं कि पदार्थ का अपने वातावरण के साथ उष्मा के अलावा किसी रूप में ऊर्जा का आदान-प्रदान नहीं हुआ है। यानी
प्राप्त उष्मा उ उष्मीय ऊर्जा में बढ़त अ आंतरिक रिस्थतिज ऊर्जा में बढ़त उ पदार्थ की कुल आंतरिक ऊर्जा में बढ़त
यानी आणविक स्तर पर हम कह सकते हैं कि उष्मा पदार्थ की वो आंतरिक ऊर्जा है तो तापमान भिन्न होने के कारण उसे प्राप्त होती है या उससे निकास होती है।
तापमान वृद्धि किसमें ज़यादा
उष्मा मिलने पर तापमान बढ़ता है यह बात तो साफ है। पर हमारा अनुभव यह भी बताता है कि सभी पदार्थो में यह बढ़ोत्तरी एक सरीखी नहीं होती। मसलन, आपके आप एक तापमान पर बराबर वज़न के दो टुकड़े हैं - एक एल्यूनिनियम का, दूसरा तांबे का। आप इन दोनों में बराबर मात्रा में उष्मा देते हैं। अब बताइए कि क्या दोनों टुकड़ों में तापमान की बढ़त एक-सी होगी? शायद आपको यह जानकर अचरज हो कि अगर तांबे का तापमान 100 डिग्री सेल्सियस से बढ़ता है तो एल्यूमिनियम के तापमान में मात्र 44 डिग्री सेल्सियस का इज़ाफा होगा। अगर आप चाहते हैं कि एल्यूनिनियम का तापमान भी 100 डिग्री सेल्सियस बढ़े तो आपको एल्यूमिनियम को तांबे के मुकाबले तकरीबन दुगनी से भी ज़्यादा उष्मा देनी होगी।
हम इसी प्रयोग को पारे ओर पानी के साथ दोहराएं तो पाएंगे कि जितनी उष्मा से पारे का तापमान 100 डिग्री सेल्सियस बढ़ जाता है उतनी उष्मा (बराबर वज़न के) पानी के तापमान में सिर्फ 3.. डिग्री सेल्सियस का फर्क ला पाती है। आप सोच रहे होंगे कि भला इतना फर्क क्यों?
यह इसलिए कि मिलने वाली उष्मा का कितना भाग उष्मीय में जाएगा और कितना आंतरिक स्थितिज ऊर्जा में - इसका अनुपात हरेक पदार्थ में भिन्न होता है। किसी पदार्थ में प्राप्त उष्मा का ज़्यादा बड़ा भाग आंतरिक ऊर्जा में परिवर्तित होता है तो किसी में कम। अब ज़ाहिर है कि प्राप्त उष्मा का जितना बड़ा भाग आंतरिक स्थितिज ऊर्जा में परिवर्तित होगा तापमान उतना ही कम बढ़ेगा। उपरोक्त उदाहरणों में तापमानों की बढ़ोतरी में अंतर की पीछे इसी फर्क का हाथ है। मसलन पारे की अपेक्षा पानी में प्राप्त उष्मा का ज़्यादा बड़ा भाग आंतरिक स्थितिज ऊर्जा में परिवर्तित होता है। इसलिए उष्मा सोखने पर पानी नहीं होता जितना कि पारे का। ऐसे में स्वाभाविक है कि तापमान में बढ़ोतरी भी (पानी की बनिस्बत) पारे में ही ज़्यादा होगी।
ऊर्जा संग्रह क्षमता अलग-अलग
यानी सभी पदार्थो में आंतरिक ऊर्जा संग्रह करने की क्षमता एक समान नहीं होती। कोई अपने में ज़्यादा गर्मी सोख पाता है तो कोई कम। लेकिन उष्मा और तापमान का यह रिश्ता एक तरफा नहीं होता। यानी अगर कोई पदार्थ अन्य किसी पदार्थ की तुलना में ज़्यादा गर्मी सोख पाता है तो गर्म होने पर वही पदार्थ अपने सम्पर्क में आई ठंडी वस्तुओं का औरों से ज़्यादा उष्मा भी प्रदान करेगा।
इस बात का दर्द सहित एहसास हमें उस समय भी होता है जब ऊपर से ठीक-ठाक गर्म दिखने वाले आलू के पराठे खाकर हम अपनी जीभ जला बैठते हैं। यह इसलिए कि आलू का काफी बड़ा हिस्सा पानी होता है और पानी में आंतरिक ऊर्जा संग्रह करने की क्षमता काफी ज़्यादा होती है। इसलिए हालांकि पराठे में आलू और आटा एक ही तापमान पर होते हैं पर जीभ के सम्पर्क में आने पर आटे की अपेक्षा आलू ज़्यादा उष्मा जीभ को स्थानांतरित कर देता है। अब ऐसे में जीभ कैसे न जले! पदार्थों के इस अंतर को हम विशिष्ट उष्मा की अवधारणा के ज़रिए दर्शाते हैं।
हरेक पदार्थ की अपनी एक विशिष्ट उष्मा होती है और वह यह दर्शाती है कि उस पदार्थ का एक इकाई द्रव्यमान, तापमान एक डिग्री बढ़ने पर कितनी ऊर्जा अपने में समेट सकता है। या फिर तापमान एक डिग्री घटने पर कितना ऊर्जा उष्मा के रूप में अपने वातावरण को दे सकता है। मिसाल के तौर पर पानी की विशिष्ट उष्मा है - 1 कैलोरी/ग्राम/डिग्री सेल्सियस। इसका अर्थ यह हुआ कि पानी का एक ग्राम 1डिग्री सेल्सियस तापमान बढ़ाने पर अपने में 1 कैलोरी उष्मा समेट लेता है। दूसरे शब्दों में एक कैलोरी उष्मा, एक ग्राम पानी का तापमान 1 डिग्री सेल्सियस बढ़ा देती है। वैसे अगर कुछ विरले पदार्थों को छोड़ दिया जाए तो हम पाते हैं की पानी की विशिष्ट उष्मा अन्य पदार्थों से अधिक है। यही वजह है कि इंजनों को ठंडा रखने के लिए पानी इस्तेमाल किया जाता है।
 विशिष्ट उष्मा को समझने के साथ ही हम पहुंचते हैं चर्चा के अंतिम पड़ाव पर। वैसे अब तक आपको अंदाज़ा लग गया होगा कि उष्मा की जो तस्वीर हमने पेश की वह किसी एक कलाकार की कृति नहीं है। कई नामी वैज्ञानिकों के के दिन-रात एक हुए है। इसको बनाने में। इस काम में प्रगति अक्सर धीमी और बेतरतीब, कभी-कभार भूल-भुलैया भरी और एक-दो लोगों के लिए तो बेहद कष्टप्रद भी रही है। मसलन, क्या आप कल्पना कर सकते हैं कि मेयर को अपने उष्मा संबंधी विचार लोगों के सामने रखने का क्या सिला मिला होगा? उन्हें ख्याति उठानी पड़ी। अपने विचारों के कारण वैज्ञानिकों के बीच भी काफी छीछालेदर हुई।
विशिष्ट उष्मा को समझने के साथ ही हम पहुंचते हैं चर्चा के अंतिम पड़ाव पर। वैसे अब तक आपको अंदाज़ा लग गया होगा कि उष्मा की जो तस्वीर हमने पेश की वह किसी एक कलाकार की कृति नहीं है। कई नामी वैज्ञानिकों के के दिन-रात एक हुए है। इसको बनाने में। इस काम में प्रगति अक्सर धीमी और बेतरतीब, कभी-कभार भूल-भुलैया भरी और एक-दो लोगों के लिए तो बेहद कष्टप्रद भी रही है। मसलन, क्या आप कल्पना कर सकते हैं कि मेयर को अपने उष्मा संबंधी विचार लोगों के सामने रखने का क्या सिला मिला होगा? उन्हें ख्याति उठानी पड़ी। अपने विचारों के कारण वैज्ञानिकों के बीच भी काफी छीछालेदर हुई।
कहते हैं इस मुसीबत के दौर में रिश्तेदारों ने भी उसका साथ न निभाया, उल्टे उन्होंने भी मेयर की भत्र्सना ही की। और-तो-और मानसिक उत्पीड़न का यह सिलसिला एक दो बरस नहीं बल्कि तकरीबन बीस सालों तक चलता रहा, इसमें भी बीस सालों तक चलता रहा, इसमें भी दस साल पागलखाने में बीते।
वस्तुपरकता और सच की दुहाई देने वाला विज्ञान-जगत भी इतना कट्टरपंथी और असहिष्णु हो सकता है - है न अजीब विडंबना!
(अजय शर्मा - एकलव्य के होशंगाबाद विज्ञान शिक्षण कार्यक्रम से संबद्ध)।

