सुशील जोशी
 रमाणु भार रसायन शास्त्र (और भौतिक शास्त्र) में एक बुनियादी चीज़ है। रसायन शास्त्री कामकाज तो स्थूल वज़न के साथ करते हैं मगर वे जानना चाहते हैं कि उन स्थूल वज़नों में पदार्थ के कितने अणु या परमाणु हैं। परमाणु भार इन दो के बीच सम्बन्ध स्थापित करने का तरीका है।
रमाणु भार रसायन शास्त्र (और भौतिक शास्त्र) में एक बुनियादी चीज़ है। रसायन शास्त्री कामकाज तो स्थूल वज़न के साथ करते हैं मगर वे जानना चाहते हैं कि उन स्थूल वज़नों में पदार्थ के कितने अणु या परमाणु हैं। परमाणु भार इन दो के बीच सम्बन्ध स्थापित करने का तरीका है।
कहानी उन्नीसवीं सदी के शुरू में एक स्कूल अध्यापक जॉन डाल्टन के साथ शुरू हुई थी। डाल्टन, जैसा कि सब जानते हैं, ने परमाणु सिद्धान्त प्रस्तुत किया था। उनका मत था कि प्रत्येक पदार्थ अन्तत: अविभाज्य परमाणुओं से बना होता है और किसी भी पदार्थ के सारे परमाणुओं का वज़न एक बराबर होता है जबकि किसी पदार्थ के परमाणुओं का वज़न किसी अन्य पदार्थ के परमाणुओं से भिन्न होता है। उन्होंने परमाणु भार को एक अत्यन्त महत्वपूर्ण गुणधर्म मानते हुए विभिन्न तत्वों के परमाणु भार पता करने की कोशिश की।
डाल्टन जानते थे कि परमाणु बहुत छोटी इकाई है और इसका भार निकालना असम्भव होगा। लिहाज़ा, उन्होंने अपना ध्यान विभिन्न तत्वों के आपेक्षिक परमाणु भारों पर लगाया। हाइड्रोजन सबसे हल्का तत्व था। तो उन्होंने हाइड्रोजन के परमाणु भार को इकाई मान लिया। यानी हाइड्रोजन के परमाणु भार को 1 माना। इसके बाद हाइड्रोजन के साथ विभिन्न तत्वों के यौगिकों का विश्लेषण करके उनके भारों के बीच सम्बन्ध देखे। इसके आधार पर उन्होंने इनके परमाणु भारों की गणना करने के प्रयास किए।
क्रिया से कयास जैसे 8 ग्राम ऑक्सीजन 1 ग्राम हाइड्रोजन से क्रिया करती है। इसका मतलब यह होगा कि 8 ग्राम ऑक्सीजन और 1 ग्राम हाइड्रोजन में परमाणुओं की संख्या में कुछ सम्बन्ध तो होगा - जैसे हो सकता है कि दोनों में परमाणुओं की संख्या बराबर हो, या यह भी हो सकता है कि ऑक्सीजन में दुगने परमाणु हों, या हाइड्रोजन में दुगने परमाणु हों। कैसे पता चले कि हाइड्रोजन और ऑक्सीजन के परमाणु किस अनुपात में क्रिया करते हैं। आप देख ही सकते हैं कि यदि हाइड्रोजन और ऑक्सीजन के 1-1 परमाणु का आपस में क्रिया करना स्वीकार किया जाए, तो ऑक्सीजन का एक परमाणु हाइड्रोजन के 1 परमाणु से 8 गुना भारी होगा। मगर यदि हाइड्रोजन के दो परमाणु ऑक्सीजन के एक परमाणु से क्रिया करें, तो ऑक्सीजन का एक परमाणु हाइड्रोजन के एक परमाणु से 16 गुना भारी होगा।
जैसे 8 ग्राम ऑक्सीजन 1 ग्राम हाइड्रोजन से क्रिया करती है। इसका मतलब यह होगा कि 8 ग्राम ऑक्सीजन और 1 ग्राम हाइड्रोजन में परमाणुओं की संख्या में कुछ सम्बन्ध तो होगा - जैसे हो सकता है कि दोनों में परमाणुओं की संख्या बराबर हो, या यह भी हो सकता है कि ऑक्सीजन में दुगने परमाणु हों, या हाइड्रोजन में दुगने परमाणु हों। कैसे पता चले कि हाइड्रोजन और ऑक्सीजन के परमाणु किस अनुपात में क्रिया करते हैं। आप देख ही सकते हैं कि यदि हाइड्रोजन और ऑक्सीजन के 1-1 परमाणु का आपस में क्रिया करना स्वीकार किया जाए, तो ऑक्सीजन का एक परमाणु हाइड्रोजन के 1 परमाणु से 8 गुना भारी होगा। मगर यदि हाइड्रोजन के दो परमाणु ऑक्सीजन के एक परमाणु से क्रिया करें, तो ऑक्सीजन का एक परमाणु हाइड्रोजन के एक परमाणु से 16 गुना भारी होगा।
19वीं सदी की शुरुआत में यह समझ बन रही थी कि 8 ग्राम ऑक्सीजन 1 ग्राम हाइड्रोजन से क्रिया करती है। इसका मतलब यह होगा कि 8 ग्राम ऑक्सीजन और 1 ग्राम हाइड्रोजन में परमाणुओं की संख्या में कुछ सम्बन्ध तो होगा। ऑक्सीजन की क्रिया ज़्यादा तत्वों से होती है इसलिए आगे चलकर हाइड्रोजन की बजाय ऑक्सीजन को परमाणु भार का मानक वज़न बनाने का विचार उठा।
डाल्टन के पास यह पता करने का कोई तरीका नहीं था कि जब दो तत्व आपस में क्रिया करते हैं तो वे किस अनुपात में क्रिया करेंगे। तो उन्होंने यह माना कि तत्व आपस में क्रिया 1-1 परमाणु के अनुपात में करेंगे। इस मान्यता के आधार पर उन्होंने उस समय ज्ञात तत्वों के परमाणु भारों की तालिका प्रकाशित की।
 परमाणु भार ही परमाणु भार
परमाणु भार ही परमाणु भार
लगभग इसी समय अध्ययन की एक और विधा प्रचलित थी। गैसों की आपसी क्रियाओं का अध्ययन। जहाँ डाल्टन तत्वों की क्रियाएँ करके उनके भारों का माप-तौल करके परमाणु भारों की परस्पर तुलना करते थे वहीं कुछ अन्य वैज्ञानिक यह देखते थे कि जब गैसें आपस में क्रियाएँ करती हैं तो उनके आयतनों में क्या सम्बन्ध होता है। इनमें गैलूसेक का नाम प्रमुखता से लिया जाता है। इन अध्ययनों में एक नियम निकला - बात को संक्षेप में कहें तो यह एवोगैड्रो नियम था। इसके अनुसार समान ताप व दाब पर गैसों के बराबर आयतन में अणुओं की संख्या बराबर होती है। तो गैसों के परमाणु भारों की तुलना का एक तरीका यह भी सामने आया। इस नियम से गणना करने के लिए आपको विभिन्न गैसों के घनत्व की तुलना करना है; वही उनके परमाणु भार के सम्बन्ध को दर्शाएगा।
 इन दो तरीकों से परमाणु भार अकसर अलग-अलग निकलते थे। गौरतलब बात यह है कि इनमें से डाल्टन का तरीका मूलत: पदार्थों के रासायनिक विश्लेषण पर आधारित था जबकि एवोगैड्रो का तरीका गैसों के घनत्व जैसे भौतिक गुण और फिर पदार्थों के रासायनिक विश्लेषण पर टिका था। मगर दोनों में ही हाइड्रोजन का परमाणु भार 1 माना जाता था।
इन दो तरीकों से परमाणु भार अकसर अलग-अलग निकलते थे। गौरतलब बात यह है कि इनमें से डाल्टन का तरीका मूलत: पदार्थों के रासायनिक विश्लेषण पर आधारित था जबकि एवोगैड्रो का तरीका गैसों के घनत्व जैसे भौतिक गुण और फिर पदार्थों के रासायनिक विश्लेषण पर टिका था। मगर दोनों में ही हाइड्रोजन का परमाणु भार 1 माना जाता था।
मेंडलीव और परमाणु भार: मेंडेलीव ने जब आवर्त सारणी बनाने का काम शुरू किया, तो उन्होंने परमाणु भार को आधार मानकर तत्वों की जमावट शुरू की। उनके द्वारा परमाणु भार की गणना को प्रदर्शित करता हुआ एक पृष्ठ यहाँ दे रहे हैं, हालाँकि, इसमें पठनीयता कम है।
इसी बीच एक वैज्ञानिक हुए जॉन जैकब बर्ज़ीलियस। उन्होंने सोचा कि सारे तत्वों की तुलना हाइड्रोजन से करना थोड़ा मुश्किल है क्योंकि हाइड्रोजन बहुत ही कम तत्वों से क्रिया करती है। दूसरी ओर ऑक्सीजन कई तत्वों से क्रिया करती है। तो बर्ज़ीलियस ने ऑक्सीजन को मानक इकाई लिया और उसका परमाणु भार 100 निर्धारित कर दिया। जल्दी ही बर्ज़ीलियस ने कई तत्वों के परमाणु भारों की तालिका ऑक्सीजन का परमाणु भार 100 मानकर तैयार करके प्रकाशित कर दी।


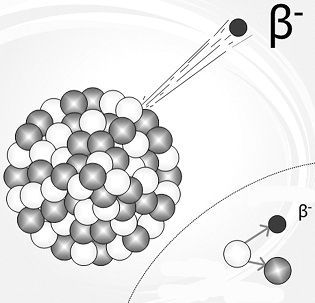
अल्फा एवं बीटा क्षय: रेडियो एक्टिव पदार्थों के अध्ययन से यह बात समझ में आई कि इन पदार्थों से तीन अलग-अलग गुणधर्मों वाले कणों की बौछार होती है, जिन्हें अल्फा, बीटा और गामा नाम दिए गए। एक अल्फा कण दो प्रोटॉन और दो न्यूट्रॉन से मिलकर बना होता है इसलिए तत्व से एक अल्फा कण निकलने से तत्व का भार चार इकाई कम हो जाएगा। दूसरी ओर, बीटा कण एक इलेक्ट्रॉन है। तत्व से बीटा कण के निकलने से परमाणु भार पर तो कोई असर नहीं पड़ता, लेकिन ऋणावेश एक इकाई कम होने के कारण एक इकाई धनावेश बढ़ जाता है।
धीरे-धीरे रसायन शास्त्र का शोध साहित्य डाल्टन, एवोगैड्रो व बर्ज़ीलियस के अनुयायियों द्वारा प्रकाशित शोध पत्रों में इस्तेमाल किए गए अलग-अलग परमाणु भारों के कारण भ्रामक स्थिति में पहुँच गया। अन्तत: 1869 में ऑगस्ट केकुले द्वारा आयोजित सम्मेलन में स्टानिसलाओ कैनिज़रो के प्रयासों से परमाणु भार को लेकर सहमति बनी और हाइड्रोजन को परमाणु भार की इकाई मान लिया गया।
समस्थानिकों ने और उलझाया
तो लगा कि परमाणु भार की गुत्थी सुलझ गई है और मेंडेलीव व लोथर मेयर अपनी-अपनी आवर्त तालिकाएँ बनाने का काम सुचारु रूप से कर सकते हैं, जो उन्होंने किया भी। मगर तभी एक बार फिर उथल-पुथल मच गई। बीसवीं सदी के शुरू में फ्रांसीसी वैज्ञानिक ए.एच. बेकरेल ने रेडियो-सक्रियता की खोज कर डाली। देखा गया कि कुछ तत्व रेडियोसक्रिय होते हैं यानी उनमें से विघटन होता रहता है (जब यह विघटन होता है तो कुछ विकिरण निकलता है, इसलिए ऐसे तत्वों को रेडियोसक्रिय कहते हैं)। इसका मतलब यह हुआ कि ये तत्व और इनके विघटन से बने उत्पादों के परमाणु भार अलग-अलग हो सकते हैं। विघटन में कई तरह के विकिरण उत्सर्जित होते हैं। ऐसा ही एक विकिरण अल्फा कणों से बना होता है, जो काफी भारी होते हैं। डब्लू. रेम्से और एफ. सोडी ने पता लगाया कि अल्फा कण दरअसल, हीलियम के नाभिक होते हैं। सोडी ने यह भी दर्शाया कि मीसोथोरियम 1 (228RA) और रेडियम रासायनिक रूप से एक ही तत्व हैं। इस खोज के आधार पर उन्होंने निष्कर्ष निकाला कि ऐसे रासायनिक तत्व होते हैं जिनके रेडियोसक्रिय गुणधर्म अलग-अलग हैं मगर रासायनिक गुण एक समान होते हैं। और सबसे महत्वपूर्ण बात तो यह थी कि इनके परमाणु भार अलग-अलग होते हैं। रासायनिक रूप से हूबहू एक-से होने के कारण आवर्त तालिका में ये एक ही स्थान पर रखे जाएँगे - यानी ये समस्थानिक हैं।
उस समय सोचा गया कि किसी तत्व के समस्थानिक पाया जाना चन्द रेडियोसक्रिय तत्वों का गुण होगा। यह तो कोई सोच भी नहीं सकता था कि हाइड्रोजन के भी समस्थानिक होंगे।
जब रेडियोसक्रिय तत्वों का अध्ययन किया गया तो पता चला कि प्रत्येक रेडियोसक्रिय तत्व का विघटन एक निश्चित क्रम में होता है और अन्त में कोई दूसरा तत्व बन जाता है। जैसे थोरियम (232) व युरेनियम (238) अल्फा कण तथा बीटा कण गवाँकर लेड के विभिन्न स्थिर समस्थानिकों में बदल जाते हैं - लेड (208) और लेड (206)। इसका मतलब हुआ कि लेड का परमाणु भार इस बात पर निर्भर करेगा कि उसका निर्माण किस रास्ते से हुआ है। और वास्तविक मापन से यह बात सही पाई गई - लेड का परमाणु भार उसके स्रोत व स्रोत की आयु पर निर्भर करता है। सामान्य लेड का परमाणु भार 207.2 पाया गया। दूसरी ओर यदि लेड को थोरियम सिलिकेट खनिज से प्राप्त किया जाए, तो उसका परमाणु भार 208.3 निकलता है। यही लेड यदि युरेनियम खनिज से प्राप्त किया जाए, तो परमाणु भार 206.4 निकलता है। इन अन्तरों का कारण यह है कि अलग-अलग स्रोतों से प्राप्त लेड के नमूनों में उसके अलग-अलग समस्थानिकों का अनुपात अलग-अलग होता है।
इसका परिणाम यह हुआ कि ऐसे तत्वों के परमाणु भार पूर्णांक संख्याओं में ना रहकर दशमलव संख्याओं के रूप में प्राप्त होने लगे। वैसे तो डाल्टन व अन्य समकालीन वैज्ञानिकों को भी दशमलव में परमाणु भार मिलते थे मगर वे इन्हें प्रायोगिक त्रुटि मानकर सन्निकटन कर लेते थे। उपरोक्त विवरण से ऐसा लग सकता है कि तत्वों के परमाणु भारों का दशमलव संख्याओं में आना सिर्फ समस्थानिकों की उपस्थिति की वजह से है। मगर जैसा कि हम अन्त में बात करेंगे, तत्वों के परमाणु भारों का पूर्णांक संख्या में न होना सिर्फ इसी वजह से नहीं होता।
समस्थानिक अपवाद नहीं
परमाणु भार के क्षेत्र में एक और अफरा-तफरी मची जब जे.जे. थॉमसन नेे नियॉन के स्थिर समस्थानिक खोज निकाले। थॉमसन ने दर्शाया कि नियॉन के कम-से-कम दो समस्थानिक पाए जाते हैं - इनके परमाणु भार 20 और 22 होते हैं तथा ये 9:1 के अनुपात में पाए जाते हैं। इस खोज के बाद यह स्पष्ट करने में मदद मिली कि क्यों प्राकृतिक रूप से पाई जाने वाली नियॉन का परमाणु भार 20.2 निकलता है।
धीरे-धीरे पता चला कि समस्थानिक पाया जाना कोई अपवाद नहीं बल्कि सामान्य बात है। उदाहरण के लिए मात्र 21 तत्व ही ऐसे हैं जिनका एक ही टिकाऊ समस्थानिक पाया जाता है। इनके अलावा, 25 से ज़्यादा तत्व तो ऐसे हैं जिनका एक भी टिकाऊ समस्थानिक नहीं पाया जाता या इनका परिवर्तन इतनी तेज़ी से होता है कि प्रकृति में इनका एकरूप समस्थानिक संघटन नहीं है। तो यह साफ हो गया कि अधिकांश तत्वों के एक से अधिक समस्थानिक पाए जाते हैं।
इस समय तक ऑक्सीजन को परमाणु भार की इकाई माना जाने लगा था। हमने ऊपर देखा था कि बर्ज़ीलियस ने भी ऑक्सीजन को परमाणु भार की इकाई माना था मगर उन्होंने ऑक्सीजन का परमाणु भार 100 माना था। आगे चलकर जब एक बार फिर ऑक्सीजन को परमाणु भार की इकाई माना गया तो उसका परमाणु भार 16 माना गया था।
अलबत्ता, इस मामले में भी गफलत कम नहीं थी। जैसा कि ऊपर कहा गया, अधिकांश तत्वों के एक से अधिक समस्थानिक पाए जाते हैं। ऑक्सीजन भी इसकी अपवाद नहीं है। ऑक्सीजन के तीन टिकाऊ समस्थानिक पाए जाते हैं। इनके परमाणु भार क्रमश: 16, 17 व 18 हैं। इनके संकेत 16O, 17O, और 18O हैं। आगे की बात करने से पहले एक छोटी-सी बात और समझ लें।
फिर भी दो तालिकाएँ
बीसवीं सदी के शुरुआती वर्षों में परमाणु भार निकालने की विधियाँ मूलत: रासायनिक थीं। जिस तत्व का परमाणु भार निकालना होता था उसके विभिन्न यौगिकों का भारात्मक विश्लेषण किया जाता था और फिर इनके आधार पर परमाणु भारों की गणना की जाती थी। इस विधि को परिष्कृत करने का काम हार्वर्ड विश्वविद्यालय के रसायनज्ञों ने किया था। इनके प्रयासों के परिणामस्वरूप रसायन शास्त्र में ऑक्सीजन का परमाणु भार 16 मानकर शेष तत्वों के परमाणु भार निकाले गए और ये मानक परमाणु भार स्थापित हो गए।
बीसवीं सदी में परमाणु भार ज्ञात करने की भौतिक विधियाँ भी विकसित होने लगी थीं। इनमें खास तौर से मास-स्पेक्ट्रोमेट्री का नाम लिया जा सकता है। मास-स्पेक्ट्रोमेट्री विधि से किसी भी तत्व के समस्थानिकों की गणना अलग-अलग की जा सकती है। इसके आधार पर तत्व का औसत परमाणु भार निकाला जा सकता है। भौतिक शास्त्रियों ने इस पर ज़्यादा भरोसा किया। उन्होंने 16ग्र् का परमाणु भार 16 मानकर तत्वों के परमाणु भार की तालिका बना ली।
तो बीसवीं सदी के मध्य में परमाणु भारों की दो तालिकाएँ बन गईं - एक रसायनविदों के लिए और दूसरी भौतिकविदों के लिए। जहाँ रासायनिक परमाणु भार तालिका कुदरती ऑक्सीजन का परमाणु भार 16 मानकर तैयार की गई थी वहीं भौतिकी परमाणु भार तालिका ऑक्सीजन के एक समस्थानिक (10O) का परमाणु भार 16 मानकर तैयार की गई थी। ज़ाहिर है, इनमें अन्तर था। कुदरती रूप से मिलने वाली ऑक्सीजन में तो तीनों समस्थानिक होते हैं, इसलिए उसका परमाणु भार वास्तव में 16.0045 था। तो यदि इसे 16 मानकर चलेंगे तो सारे परमाणु भार थोड़े अलग तो निकलेंगे ही।
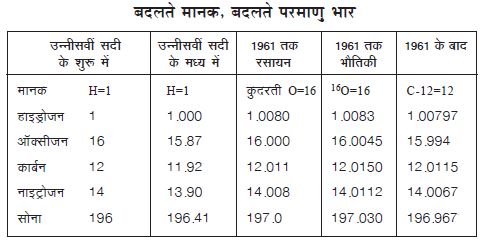
1961 में परमाणु भारों के दो आँकड़ों में अन्तर आगे तालिका में देखिए।
अब ज़रा सोचिए, कितनी दिक्कत होती होगी यदि भौतिक शास्त्र के शोध पत्र में प्रकाशित आँकड़ों को कोई रसायन शास्त्री पढ़े या इससे उलटा हो। मगर फिर भी एक सहूलियत थी। हम यह मान सकते थे कि रासायनिक परमाणु भारों को भौतिक परमाणु भारों में बदलने के लिए एक सीधा सूत्र होगा क्योंकि अन्तर तो बस यही है ना कि उनकी मानक इकाइयाँ अलग-अलग हैं और हम जानते हैं कि यह अन्तर कितना है। यानी एक स्थिरांक से गुणा करके रासायनिक परमाणु भारों को भौतिकी परमाणु भारों में बदला जा सकता है। ठीक वैसे ही जैसे इंच-फुट में दिए गए आँकड़ों को सेंटीमीटर-मीटर में बदला जाता है। इकाई परिवर्तन में कोई दिक्कत नहीं होती क्योंकि इकाइयों के बीच एक निश्चित सम्बन्ध होता है। मगर परमाणु भार ने एक बार फिर हमें छकाया।
इनमें सम्बन्ध भी सरल नहीं!
आम तौर पर माना जाता था कि किसी भी तत्व के टिकाऊ समस्थानिकों का अनुपात स्थिर रहता है। यानी मान्यता यह थी कि ऑक्सीजन किसी भी स्रोत से प्राप्त की जाए, उसमें तीनों समस्थानिकों का अनुपात वही रहेगा। जब समस्थानिकों का अनुपात वही है तो उसका औसत परमाणु भार वही रहना चाहिए। मगर...।
मगर किसी भौतिकविद् ने पता लगाया कि ऑक्सीजन में समस्थानिकों का अनुपात स्रोत के अनुसार बदलता रहता है। और सिर्फ ऑक्सीजन का ही नहीं अधिकांश तत्वों का समस्थानिक अनुपात बदलता रहता है।
|
समस्थानिकों का अलग-अलग अनुपात कुछ तत्वों के समस्थानिक विभिन्न भौतिक, रासायनिक व जैविक क्रियाओं के दौरान अलग-अलग होते हैं। इनमें अवस्था परिवर्तन (वाष्पन, संघनन, रवे बनाना, पिघलना, और ऊर्ध्वपातन), आयन एक्सचेंज, अवशोषण, विसरण, दाब-युक्त छनाई, वगैरह शामिल हैं। इनके अलावा प्रकाश संश्लेषण, श्वसन जैसी जैविक क्रियाओं के दौरान भी तत्वों के अलग-अलग समस्थानिकों का उपयोग अलग-अलग अनुपात में किया जाता है। उदाहरण के लिए, 1939 में यह पता चल चुका था कि विभिन्न नमूनों में कार्बन-13 और कार्बन-12 के अनुपात में 5 प्रतिशत तक का अन्तर होता है। यानी कार्बन का परमाणु भार स्रोत पर निर्भर है। हाइड्रोजन के सन्दर्भ में यही स्थिति होती है। विभिन्न स्रोतों से प्राप्त नमूनों में हाइड्रोजन-2 और हाइड्रोजन-1 के अनुपात की तुलना जिस मानक से की जाती है वह है विएना मानक औसत समुद्री जल (VSMOW)। हाइड्रोजन के समस्थानिक अनुपात में अन्तर का प्रमुख कारण यह है कि 1H210O तथा 1H2H10O(पानी के दो रूप) के वाष्प दाब अलग-अलग होते हैं। लिहाज़ा, दोनों का वाष्पन व संघनन अलग-अलग गति से होता है। परिणामस्वरूप, पृथ्वी पर पानी में हाइड्रोजन-2 की मात्रा 0.0082 प्रतिशत से लेकर 0.025 प्रतिशत तक पाई जाती है। यदि ध्रुवों पर जमा बर्फ को लें और समुद्री पानी को लें, तो ध्रुवों की बर्फ में हाइड्रोजन-2 की मात्रा समुद्री पानी के मुकाबले मात्र दो तिहाई होती है। यदि सारे स्रोतों का विश्लेषण किया जाए, तो हाइड्रोजन का परमाणु भार 1.007851 से लेकर 1.008010 तक निकलता है। हाइड्रोजन के समस्थानिक अनुपात के सटीक मापन से हमें जल चक्र, मौसम विज्ञान, पुराजलवायु तथा ब्रह्माण्डीय रासायनिक क्रियाओं के बारे में महत्वपूर्ण जानकारियाँ मिली हैं। |
अब रसायन शास्त्रियों की शामत आ गई। वे तो मानकर चल रहे थे, तत्वों का समस्थानिक अनुपात पृथ्वी पर स्थिर है। तो आप चाहे ऑक्सीजन-16 को मानक मानें या औसत ऑक्सीजन को मानक मानें, कोई फर्क नहीं पड़ेगा। मगर यदि अलग-अलग स्रोतों से प्राप्त ऑक्सीजन में समस्थानिकों का अनुपात अलग-अलग है तो मानक किसे मानेंगे?
यह एक नई समस्या खड़ी हो गई। इस मुकाम पर (1961 में) अन्तर्राष्ट्रीय वैज्ञानिक समुदाय ने सोच-समझकर फैसला किया कि परमाणु भार का मानक कार्बन का वह समस्थानिक होगा जिसके परमाणु में 6 प्रोटॉन और 6 न्यूट्रॉन होते हैं (सीधे-सादे शब्दों में जिसका परमाणु भार हाइड्रोजन को 1 मानकर 12 है)। तो 1961 में 12C को परमाणु भार की मानक इकाई घोषित किया गया और इसका परमाणु भार 12 माना गया।
आपके मन में यह सवाल ज़रूर उठ रहा होगा कि कार्बन को मानक क्यों माना गया। दरअसल, कार्बन-12 को परमाणु भार का मानक बनाने का प्रस्ताव 1957 में दो वैज्ञानिकों ने रखा था। एक कारण तो यह बताते हैं कि कार्बन का उपयोग एक मानक के रूप में परमाणु संहति के निर्धारण में पहले से किया जाता रहा था। दूसरा ज़्यादा व्यावहारिक कारण यह बताते हैं कि कार्बन को मानक चुनने पर रसायन शास्त्रियों और भौतिक शास्त्रियों, दोनों को अपने पैमाने बदलने पड़े थे, हालाँकि, बदलाव बहुत अधिक नहीं था। इसलिए यह ज़्यादा समतामूलक निर्णय था।
तो आजकल परमाणु भार कार्बन-12 का परमाणु भार 12 मानकर निकाले जाते हैं और परमाणु भारों की गणना के लिए रासायनिक विधियों के अलावा मास-स्पेक्ट्रोमेट्री जैसी भौतिक विधियों का उपयोग किया जाता है।
अब आपके मन में भी यह सवाल उठ रहा होगा कि आखिर परमाणु भारों में ऐसे छोटे-मोटे तुच्छ अन्तरों को लेकर इतनी हाय-तौबा मचाने की क्या ज़रूरत है। परमाणु भारों के सही-सही (दशमलव के चौथे-पाँचवे स्थान तक शुद्ध) मान पता करने से क्या फायदा है?
आयोग ही आयोग...
यह देखना भी उपयोगी होगा कि रसायन शास्त्री और भौतिक शास्त्री परमाणु भारों को लेकर कितनी ‘हाय-तौबा’ मचाते रहे हैं। ऊपर ऑगस्ट केकुले द्वारा कार्लस्रुहे नामक स्थान पर आयोजित सम्मेलन का ज़िक्र तो किया ही गया, जिसका आयोजन परमाणु भारों की समस्या को सुलझाने के विशिष्ट मकसद से किया गया था। इस हाय-तौबा का एक पैमाना वे समितियाँ हैं जिनका गठन परमाणु भार की गुत्थी सुलझाने के लिए समय-समय पर किया गया है। इनमें अन्तर्राष्ट्रीय माप-तौल ब्यूरो, परमाणु भार व समस्थानिक अनुपात आयोग, केन्द्रीय नाभिकीय मापन ब्यूरो, माप-तौल सम्बन्धी आम सम्मेलन, परमाणु ऊर्जा मापन आयोग, सन्दर्भ सामग्री व मापन संस्थान, अन्तर्राष्ट्रीय मानकीकरण संगठन, समस्थानिक अनुपात मापन उप समिति, तथा संकेत, इकाइयाँ, नामकरण, परमाणु संहति व मूलभूत स्थिरांक आयोग के नाम लिए जा सकते हैं। इनमें से परमाणु भार व समस्थानिक अनुपात आयोग तो एक स्थाई आयोग है जो हर चार सालों में परमाणु भारों की नई तालिका तैयार करता है। इससे पता चलता है कि भौतिक शास्त्री और रसायन शास्त्री, दोनों ही परमाणु भारों के परिशुद्ध मापों में गहरी रुचि रखते हैं। तो क्यों?
इतनी माथापच्ची क्यों?
जैसा कि ऊपर कहा गया था, रसायन शास्त्र में परमाणु भार वह चीज़ है जो स्थूल भार का सम्बन्ध बुनियादी इकाइयों से जोड़ने का काम करती है। परमाणु भार के सटीक मापन के आधार पर ही हम प्रत्येक पदार्थ के मोल की गणना सही-सही कर सकते हैं। 1 मोल पदार्थ से मतलब होता है कि उसमें उस पदार्थ के एवोगैड्रो संख्या के बराबर परमाणु या अणु होंगे। किसी भी पदार्थ के एक मोल का भार पदार्थ के परमाणु या अणु भार से तय होगा। यानी जितनी सटीकता से आपको परमाणु या अणु भार पता है, उतनी ही सटीकता से आप बता पाएँगे कि 1 मोल का भार कितना होगा। इसके अलावा परमाणु भार पदार्थों की शुद्धता की जाँच का भी एक तरीका है। खास तौर से परमाणु भार मापन के आधार पर सम्बन्धित नमूने में तत्व के समस्थानिक अनुपात की गणना की जा सकती है। ऊपर हमने देखा ही था कि कई तत्वों का समस्थानिक अनुपात उनके प्राप्त होने के स्रोत पर निर्भर करता है। समस्थानिक अनुपातों और स्रोत के मामले में अच्छे आँकड़े उपलब्ध हों, तो हम किसी भी पदार्थ की उत्पत्ति के स्रोत के बारे में काफी कुछ कह सकते हैं। दरअसल, आजकल ‘समस्थानिक हस्ताक्षर’ (किसी नमूने में विभिन्न तत्वों के समस्थानिकों के अनुपात) काफी प्रचलन में हैं। परमाणु भार का उपयोग औद्योगिक दृष्टि से भी महत्व रखता है।
भौतिक शास्त्रियों के लिए सटीक परमाणु भारों का महत्व यह है कि इनके आधार पर अन्य मूलभूत स्थिरांकों की गणना की जाती है। जैसे नाभिकीय ऊर्जा की सही गणना के लिए परमाणु भार का परिशुद्ध मापन अनिवार्य है। मैंने दशमलव में निकले परमाणु भारों की चर्चा करते हुए कहा था कि परमाणु भारों के पूर्णांक में न आने का एक कारण समस्थानिकों की उपस्थिति है। मगर मैंने यह भी कहा था कि वही एकमात्र कारण नहीं है। यह तो आप जानते ही हैं कि परमाणु के नाभिक में प्रोटॉन व न्यूट्रॉन पाए जाते हैं। प्रोटॉन धनावेशित कण हैं। ये एक-दूसरे को विकर्षित करते हैं। इन्हें नाभिक में एक साथ बनाए रखने में ऊर्जा खर्च होती है। नाभिक को स्थिर रखने के लिए ऊर्जा इन्हीं कणों से प्राप्त होती है। तो नाभिक की संहति उसके कणों की संहति के योग के बराबर नहीं होती। थोड़ी कम होती है। इस ऊर्जा की गणना के लिए परमाणु भार का मान अत्यन्त शुद्धता से पता होना ज़रूरी है।
और भी कई भूमिकाएँ हो सकती हैं परमाणु भारों की जिनके बारे में पता लगते ही आपको सूचना दूँगा।
फिलहाल मैं गैलूसेक के अवलोकनों की बर्ज़ीलियस द्वारा दी गई व्याख्या, उस व्याख्या के कारण उत्पन्न हुई समस्याओं, तथा एवोगैड्रो द्वारा दी गई व्याख्या की लम्बी कहानी में नहीं जा रहा हूँ। मूलत: एवोगैड्रो ने स्पष्ट किया था कि तात्विक गैसें परमाणु के रूप में नहीं बल्कि अणुओं के रूप में पाई जाती हैं। मुख्य बात यह है कि परमाणु भार ज्ञात करने की दो विधियाँ उपलब्ध हो गईं थीं।
सुशील जोशी: एकलव्य द्वारा संचालित स्रोत फीचर सेवा से जुड़े हैं। विज्ञान शिक्षण व लेखन में गहरी रुचि।