सुशील जोशी
ph से तो सिर्फ घोल में अम्ल या क्षार की प्रबलता ही मालूम पड़ेगी, इनकी कुल मात्रा मापने के लिए तो मानक घोल से उदासीनीकरण की प्रक्रिया ही अपनानी पड़ेगी।
अम्लीयता और क्षारीयता के मापन की विधि आप पढ़ चुके हैं (संदर्भ के दूसरे अंक में)। उसी अंक में आपने पीएच (ph ) मापन की विधि भी पढ़ी। शायद आप में से कुछ ने उन प्रयोगों को करके भी देखा होगा। एक बार दोहरा लेने से मदद मिलेगी।
अम्लीयता-क्षारीयता के मापन के लिए हम क्षार या अम्ल का एक मानक घोल लेते हैं। इसकी सांद्रता हमें ज्ञात है। अब जिस घोल की अम्लीयता-क्षारीयता नापनी है उसका उदासीनीकरण इस मानक घोल के निश्चित आयतन से करते हैं। फिर जाने-माने N1 x V1 = N2 x V2 के सूत्र से हम अज्ञात घोल में अम्ल क्षार की मात्रा पता लगा लेते हैं।( जहां N1 व N2 पहले और दूसरे घोल में अम्ल और क्षार की मात्रा दर्शाते हैं और V1 व V2 आयतन।)
आप यह भी जानते हैं कि अम्लीयता क्षारीयता की दूसरी माप है ph उदासीन पानी की ph 7 होती है। 7 से कम पी.एच. होने पर घोल अम्लीय कहलाता है और 7 से ज़्यादा ph हो तो क्षारीया। ph नापने के लिए यूनिवर्सल ph घोल का उपयोग किया जाता है।
बहरहाल अम्लीयता-क्षारीयता मापन की इन दो विधियों में क्या अंतर है यह समझना अनिवार्य है। मसलन सवाल यह उठता है कि यदि किसी घोल की ph 6.5 है और किसी घोल की ph 4.2 है तो किसकी अम्लीयता ज़्यादा होगी? दूसरे शब्दों में, सवाल यह है कि ph क्या दर्शाती है? या किसी क्षार की ph 8.5 है। और किसी अन्य क्षार की ph 11.3 है तो किसकी क्षारीयता ज़्यादा होगी?
इस प्रश्न का उत्तर पाने के लिए हमें अम्ल और क्षार के एक गुण पर विचार करना होगा। अम्ल वे पदार्थ हैं जो पानी में घोले जाने पर हाइड्रोजन आयन (H+) देते हैं। तथा क्षार वे पदार्थ हैं जो हाइड्रॉक्सिल आयन (OH–) देते हैं। स्वयं पानी भी कुछ हद तक विभाजित होकर हाइड्रोजन व हाइड्रॉक्सिल आयन के रूप में मौजूद रहता है।
H2O ↔ H++ OH– - - - (1)
(जाहिर है कि हम अम्ल-क्षार की अर्हिनियस अवधारणा का इस्तेमाल कर रहे हैं। हमारे मकसद के लिए वही पर्याप्त व उचित है।)
HCI ↔ H+ +CI – - - - (2)
NaOH ↔ Na+ + OH– - - - (3)
दोनों तरफ बने तीर के निशान से पता चलता है कि ये सारी क्रियाएं दोनों दिशाओं में चलती रहती हैं - इन्हें कठिन शब्दावली में उत्क्रमणीय क्रियाएं कहा जाता है। वैसे इन्हें दोतरफा क्रिया कहने से भी काम चल जाएगा। पानी का आयनीकरण (समीकरण-1 ) देखने से पता चलता है कि H+ व OH– आयन बराबर संख्या में बनते हैं। लिहाज़ा पानी उदासीन बना रहता है। मगर फिर भी हम यह गणना तो कर ही सकते हैं कि उदासीन पानी में कितने H+ आयन होते हैं और कितने OH– आयन। अलग-अलग तापमान पर ऐसी गणनाएं करके जो निष्कर्ष निकाले गए हैं, वे इस तालिका में दिए गए हैं
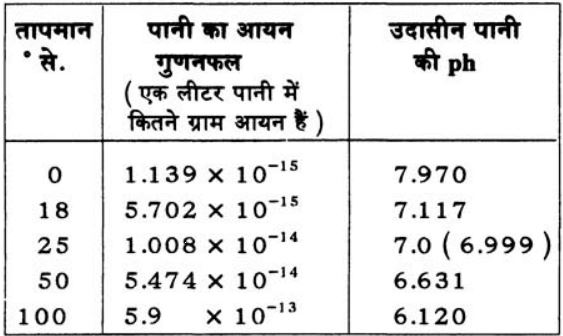 पानी का आयनों में विभाजन बहुत कम मात्रा में होता है। पानी को आयनों में विभक्त करने की प्रक्रिया में काफी ऊर्जा ( ऊष्मा ) लगती है। इसलिए तापमान बढ़ने पर आयनीकरण ज़्यादा होता है। परन्तु एक बात ध्यान में रखनी होगी कि तापमान कुछ भी हो मगर जब भी पानी के एक अणु का आयनीकरण होगा तो बराबर संख्या में H+ व OH– आयन बनेंगे।
पानी का आयनों में विभाजन बहुत कम मात्रा में होता है। पानी को आयनों में विभक्त करने की प्रक्रिया में काफी ऊर्जा ( ऊष्मा ) लगती है। इसलिए तापमान बढ़ने पर आयनीकरण ज़्यादा होता है। परन्तु एक बात ध्यान में रखनी होगी कि तापमान कुछ भी हो मगर जब भी पानी के एक अणु का आयनीकरण होगा तो बराबर संख्या में H+ व OH– आयन बनेंगे।
तालिका देखकर बताइये कि तापमान के साथ आयन गुणनफल बढ़ता है या घटता है?
आयन गुणनफल और आयन भार
H+ व OH– आयनों की मात्रा के गुणनफल को आयन गुणनफल कहते हैं। आयनों की मात्रा हम ग्राम आयन प्रति लीटर में नापते हैं। जिस तरह अणु भार को जब ग्राम के रूप में व्यक्त करते हैं तो ग्राम अणु कहते हैं उसी प्रकार से आयन भार को जब ग्राम में व्यक्त करते हैं तो उसे ग्राम आयन कहते हैं।
1 ग्राम हाइड्रोजन आयन = 1 ग्राम आयन H+
17 ग्राम हाइड्रॉक्सिल आयन = 1ग्राम आयन OH–
पानी का आयन गुणनफल = (H+) (OH–)
आप जानते ही हैं कि H+ व OH– बराबर मात्रा में बनेंगे। तालिका 1 के आधार पर बताइए कि विभिन्न तापमानों पर पानी में H+ की मात्रा कितनी होगी?
ph क्या चीज़ है?
हमने देखा कि पानी का आयनीकरण होने पर H+ और OH– आयन बनते हैं। अर्हीनियस नामक वैज्ञानिक ने यह स्पष्ट किया था कि H+ आयन अम्लीय गुण दर्शाते हैं और OH– आयन क्षारीय गुण। पानी का आयनीकरण होने पर दोनों बराबर संख्या में बनते हैं इसलिए पानी उदासीन ही रहता है - इसीलिए पानी उभयधर्मी कहलाता है।
अब मान लीजिए हम नमक के अम्ल को पानी में घोलते हैं। नमक के अम्ल का भी आयनों में विभाजन होता है:
HCI ↔ H+ + CI–
इसी प्रकार से एसिटिक अम्ल को पानी में घोलने से भी आयन प्राप्त होते हैं:
CH3COOH ↔ CH3OO– + H+
अर्थात् अम्ल घोलने पर H आयन की मात्रा बढ़ेगी। हमें फिलहाल इस बात से कोई मतलब नहीं कि ऋणात्मक आयन कौन-सा है। इसी प्रकार से किसी क्षार ( जैसे सोडियम हाइड्रॉक्साइड) को पानी में घोलें तो इस तरह आयनीकरण होता है:
NaOH ↔ Na+ + OH–
Ca(OH)2 ↔ Ca++ + 2OH–
यानी क्षार घोलें तो OH– की मात्रा बढ़ेगी। यहां एक रोचक बात पर ध्यान देना ज़रूरी है। जब हम जलीय विलयन की बात कर रहे हैं तो यह पक्की बात है कि उसमें H+ और OH– आयनों की मात्रा का गुणनफल एक निश्चित तापमान पर स्थिर रहता है।
मसलन 25 डिग्री सेल्सियस पर यह गुणनफल लगभग 7 x 10–14 होता है। यदि उसमें अम्ल डाला तो H+ आयन की सांद्रता बढ़ेगी। गुणनफल को स्थिर रखते हुए उसी अनुपात में OH– की सांद्रता कम हो जाएगी। इसी प्रकार से क्षार मिलाने पर OH– की सांद्रता बढ़ती है और उसी अनुपात में H+ की सांद्रता घट जाती है।
ऐसा क्यों होता है उसमें बाद में जाएंगे। पहले इसका एक फायदा देख लें। H+ व OH– के इस संतुलन की वजह से फायदा यह होता है, कि इनमें से किसी एक की सांद्रता मालूम हो तो दूसरे की सांद्रता की गणना की जा सकती है बशर्ते कि दोनों आयनों का गुणनफल मालूम है।
ऐसा क्यों होता है?
अगर पानी में नमक का अम्ल मिलाया जाए तो उसमें दोनों का आयनीकरण होगा। इन्हें समीकरणों के रूप में इस तरह लिख सकते हैं:
HCI ↔ H+ + CI–
H2O ↔ H+ + OH–
इन दोनों में ही H आयन उत्पन्न हो रहे हैं। सरल शब्दों में कहें तो इन दो क्रियाओं के बीच प्रतिस्पर्धा होती है। इस प्रतिस्पर्धा में पानी का आयनन कम हो जाता है। अतः OH– की संख्या भी कम हो जाती है। इसी प्रकार से पानी और कॉस्टिक सोडा के घोल में:
H2O ↔ H++ OH–
NaOH ↔ Na+ + OH–
यहां भी दोनों के बीच प्रतिस्पर्धा के कारण पानी का आयनन कम हो जाता है तथा इस तरह से H– की मात्रा कम हो जाती है।
उदासीन पानी में 14 डिग्री सेल्सियस पर आयन गुणनफल लगभग 10–14 है। इसमें बराबर मात्रा में H+ व OH– आयन हैं। यदि इसमें H+ आयन की संख्या बढ़े तो OH– की संख्या कम हो जाएगी क्योंकि इन दो का गुणनफल तो स्थिर रहना है। अर्थात् अम्लीयता और क्षारीयता, दोनों को H+ आयनों की मात्रा के रूप में प्रदर्शित किया जा सकता है।
सुविधा की दृष्टि से ( ध्यान रखें सिर्फ सुविधा की दृष्टि से ) H+ की मात्रा दर्शाने का एक अनोखा तरीका खोजा गया है।
आइए उस तरीके को देखें। सबसे पहले H+ आयन की मात्रा (ग्राम आयन प्रति लीटर) का लघुगणक या log निकाल लेते हैं। मसलन यदि H+ की मात्रा 10–7 ग्राम आयन प्रति लीटर है तो
log ( H+ ) = log 10–7 = –7
अब इसको ऋणात्मक बना देते हैं।
(–) x (–7 ) = 7
इसी संख्या को ph कहते हैं। दूसरे शब्दों में ph वह संख्या है जो H+ की ग्राम आयन प्रति लीटर मात्रा का ऋणात्मक log या लघुगणक है। इसके अनुसार 25 डिग्री सेल्सियस पर उदासीन पानी की ph 7 होगी।
यदि H+ आयन की सांद्रता बढ़े तो ph कम हो जाएगी। उदाहरण के लिए किसी घोल में 10–2 ग्राम आयन प्रति लीटर H+ है तो इसकी ph
–log 10–2 = (–) –2 = 2 होगी
→ ज़रा गणना कीजिए की ph 4 वाले घोल में OH– की सांद्रता कितनी होगी? यहां यह स्पष्ट करना ज़रूरी है कि अम्लीय घोल में भी OH– आयन मौजूद होते हैं। मगर इनकी मात्रा H+ आयन से कम होती है।
→ किसी घोल में H+ की मात्रा 3 x 10–2 ग्राम आयन प्रति लीटर है। इसकी ph कितनी होगी?
→ यदि इस घोल में H+ की मात्रा दुगुनी कर दी जाए तो इसकी ph कितनी हो जाएगी?
→ यदि H+ आयन की मात्रा 10 गुनी कर दी जाए तो इसकी ph कितनी हो जाएगी?
ph दो बातों पर निर्भर है। पहली बात है कि उस घोल में कितना अम्ल मिलाया गया है? और दूसरी बात है कि अम्ल का आयनों में विभाजन कितने हद तक हुआ है। जितना ज्यादा विभाजन होगा, तद्नुसार ph भी उतनी ही ज्यादा होगी। अलग-अलग अम्लों का विभाजन (आयनीकरण) अलग-अलग हद तक होता है। प्रबल अम्लों का आयनीकरण काफी ज्यादा होता है। प्रबल अम्लों के तनु घोल में तो लगभग पूरा अम्ल ही आयनों के रूप में मौजूद रहता है। दुर्बल अम्लों का आयनीकरण अपूर्ण होता है। उदाहरण के लिए
प्रबल अम्ल
HCI = H+ + CI–
दुर्बल अम्ल
CH3COOH = CH3OO– + H+
( तीर की लंबाई से क्रिया की रफ्तार का पता चलता है।)
ऊपर की समीकरणों से दो बातें साफ हैं
- कि अम्ल/क्षार के आयनीकरण की क्रिया दोतरफा क्रिया है। यानी अम्ल/क्षार विभक्त होकर आयन बनाते हैं। और आयन वापस जुड़कर अम्ल/क्षार बना देते हैं।
- कि विभिन्न अम्लों/क्षारों में आयनीकरण की रफ्तार और वापस जुड़ने की रफ्तार अलग-अलग होती है। किसी में आयनीकरण ज्यादा होता है तो किसी में कम। यानी एक समय पर किसी भी अम्ल/क्षार के घोल में आयनों की एक निश्चित मात्रा लेती है।
ph के द्वारा हम यही नापते हैं कि किसी भी वक्त अम्ल/क्षार के घोल में H+/OH– की मात्रा कितनी है। इसे सक्रिय अम्लीयता/क्षारीयता कहते हैं। हो सकता है कि घोल में कुल अम्ल की मात्रा ज्यादा हो मगर आयनन कम होने की वजह से उसकी ph ज्यादा आए।( ज्यादा ph का अर्थ है कि H+ आयन कम बन रहे हैं।) मसलन यदि हमने एक नार्मल ( IN ) एसिटिक अम्ल और नाइट्रिक अम्ल लिए हैं तो स्पष्ट है कि इन दोनों को उदासीन करने के लिए एक नार्मल सोडियम हाइड्रॉक्साइड के घोल के बराबर-बराबर आयतन लगेंगे। यानी इनकी अम्लीयता बराबर है मगर यदि इनमें ( IN CH3COOH और IN HNO3) H+ का
| दो बातों पर निर्भर है। पहली कि घोल में कितना अम्ल मिलाया गया है? और दूसरी कि अम्ल का आयनों में विभाजन कितने हद तक हुआ है। जितना ज्यादा विभाजन होगा, ph भी उतनी ही ज्यादा होगी। |
मापन किया जाए तो HNO3 में यह मात्रा 1 ग्राम आयन प्रति लीटर आएगी वहीं CH3COOH में मात्र 0.0034 ग्राम आयन प्रति लीटर ही होगी। यानी नाइट्रिक अम्ल के IN घोल की ph –log 1 = 0 के आसपास होगी। जबकि एसिटिक अम्ल के IN घोल की ph –log (.0034) = –log 3.4 x 10–3 = 3.5 होगी।
यानी ph द्वारा दर्शित सक्रिय अम्लीयता तथा कुल अम्लीयता में बहुत अंतर होता है।
एक बार फिर देखें
- किसी भी जलीय घोल में ph, H+ आयनों की मात्रा दर्शाती है।
- पानी में H+ और OH– आयनों की संख्या बराबर होती है। इसलिए पानी को उदासीन माना गया है।
- अम्ल पानी में घुलने पर हाइड्रोजन आयन (H+ ) देते हैं और क्षार पानी में घुलने पर हाइड्रॉक्सिल आयन (OH–) देते हैं।
- पानी में अम्ल या क्षार डालने पर H+ या OH– की संख्या घट-बढ़ सकती है। परन्तु इन दोनों आयनों का गुणनफल एक निश्चित तापमान पर स्थिर रहता है।
- क्योंकि पानी का आयन गुणनफल हमें मालूम है ( 25 डिग्री सेल्सियस पर 1.008 X 10–4 ग्राम आयन प्रति लीटर ) इसलिए सिर्फ H+ आयन की मात्रा दर्शाने से OH– की मात्रा का अंदाजा भी लग जाता है।
- ph यही दर्शाती है— पानी में आयनों की मात्रा।
ph = –log (H+)
- इसलिए ph 7 हो तो घोल उदासीन माना जाता है। 7 से कम होने पर अम्लीय और 7 से ज्यादा होने पर क्षारीय। इसलिए ph 7 हो तो घोल उदासीन माना जाता है। घोल अम्लीय हो तो H+ आयनों की संख्या ज्यादा होगी और ph कम। घोल क्षारीय हो तो OH– आयनों की संख्या ज्यादा होगी, H+ की कम - इसलिए ph ज्यादा।
- यह ध्यान रहे कि अम्लीय घोल में OH– आयन भी मौजूद होते हैं और क्षारीय में H– भी - चाहे इनकी मात्रा कम हो।
- और अंत में - सबसे महत्वपूर्ण है। किसी घोल की नॉर्मेलिटी और ph में अंतर समझना।
किसी भी घोल की नॉर्मेलिटी और मात्रा/आयतन पता होने से उस घोल में मौजूद अम्ल या क्षार की कुल मात्रा का पता चलता है।
परन्तु ph सिर्फ यह बताती है कि उस घोल में अम्ल या क्षार कितने प्रबल हैं या कमज़ोर - कितने H+ या OH– आयन छोड़ रहे हैं। ph से कुल अम्लीयता या क्षारीयता पता नहीं चलती।
( सुशील जोशी - विज्ञान एवं पर्यावरण विषयों पर सतत् लेखन।)