प्रमाद उपाध्याय
हालांकि दोनों के काम एक ही हैं, क्या फ़र्क है सेल और बैटरी में। आइए इसे समझने के साथ बनाकर भी देखें।
19वीं शताब्दी में जब ताप बिजली घरों और बांधों से बिजली बनाने की शुरुआत नहीं हुई थी तब छोटे पैमाने पर बिजली प्राप्त करने के लिए बैटरियों का उपयोग किया जाता था। आज भी हमारे रोज़मर्रा के ढेर सारे उपकरण बैटरी से चलते हैं जैसे ट्रांजिस्टर, टॉर्च, कैलकुलेटर, कैमरे की फ्लैशगन, क्वार्ट्ज़ घड़ियां आदि। बैटरियों के बारे में और बातें करने से पहले आइए खुद एक सेल बनाकर देखें।
 सेल बनाकर देखें
सेल बनाकर देखें
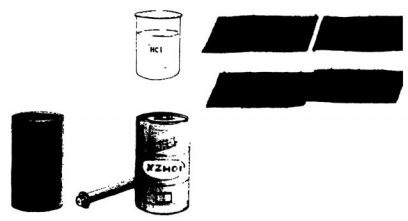
सेल बनाने के लिए हमें कुछ सामान की जरूरत पड़ेगी जैसे 4-5 बेकार टॉर्च
सामग्री: टॉर्च के खराब सेल का कागज़ हटाने के बाद निकला जस्ते का बर्तन, इसे काटकर बनी जस्ते की बड़ी पट्टी,एनोड बनाने के लिए जरूरी तांबे का तार, टॉर्च का बल्ब, कांच का बीकर, तनु हाइड्रोक्लोरिक अम्ल।
सेल, एक या दो मीटर तांबे का तार, कांच का बर्तन, तनु हाइड्रोक्लोरिक अम्ल, बिना इंसुलेशन वाले तांबे के तार का एक मोटा टुकड़ा और टॉर्च का एक बल्ब।
सेलों को तोड़कर उनका ज़िंक यानी जस्ते का खोल निकालकर ज़िंक की लम्बी-लम्बी पट्टियों काट लें। जिंक की पट्टियों को पानी से धोकर साफ कर लें। उनके किनारे चित्र में दिखाए मुताबिक आपस में फंसा दो और फिर हथौड़ी से अच्छी तरह पीटो ताकि पट्टियां आपस में एक दूसरे से जुड़ जाएं। इस तरह हमें जिंक की एक लम्बी पट्टी मिल जाएगी। एक बात का विशेष ध्यान रखना है कि जिंक की पट्टियों से एक लम्बी पट्टी बनाने में बांधने के लिए किसी तार वगैरह का इस्तेमाल नहीं करना है। इस तरह बनाई जिंक की लम्बी पट्टी के एक किनारे पर तांबे की तार बांध दो। इसके बाद जोड़ पर अच्छे से मोम लगा दो। यह हमारा कैथोड तैयार हो गया। यानी कि ऋण ध्रुव।
अब तांबे का एक बिना इंसुलेशन वाला थोड़ा मोटा तार लो। इस तार के एक सिरे पर तांबे का एक वैसा ही तार बांधो जैसा जिंक की पट्टी पर बांधा है। यह हमारा एनोड तैयार हो गया। यानी कि धन ध्रुव। अब ऋण और धन ध्रुव से बांधी गई तांबे की पतली तारों से एक टॉर्च बल्ब को जोड़ दो।
इसके बाद बर्तन में तनु हाइड्रोक्लोरिक अम्ल लो। अब इसमें पानी डालकर बर्तन को आधा भर लो। इसमें तांबे की तार के धन ध्रुव और जिंक की पट्टी के ऋण ध्रुव को डुबो दो। ध्यान रहे कि धन ध्रुव और ऋण ध्रुव से जोड़ी गई तांबे की तारों के जोड़ अम्ल में न डूबें। इसी तरह तांबे का धन ध्रुव और जिंक की लम्बी पट्टी एक दूसरे को अम्ल के अंदर न छुएं। यह बन गया हमारा सेल। परिपथ पूरा होने पर बल्ब जलना चाहिए।
 परिपथः जस्ते की पट्टियों और तांबे के तार से बनाए गए कैथोड और एनोड। बर्तन में तनु हाइड्रोक्लोरिक अम्ल और कैथोड व एनोड के बीच तार एवं टॉर्च का बल्ब लगाकर पूरा किया गया परिपथ।
परिपथः जस्ते की पट्टियों और तांबे के तार से बनाए गए कैथोड और एनोड। बर्तन में तनु हाइड्रोक्लोरिक अम्ल और कैथोड व एनोड के बीच तार एवं टॉर्च का बल्ब लगाकर पूरा किया गया परिपथ।
यदि फिर भी बल्ब न जले तो एक बार ध्यान से जांच करनी होगी कि :
- क्या धन ध्रुव वाले तांबे के तार पर कुचालक की पर्त अभी भी चढ़ी हुई है? यदि ऐसा है तो तांबे के तार के ऊपर लगा कुचालक जलाकर निकाल दो।
- जिंक की पट्टी और तांबे का एनोड अम्ल के घोल में एक-दूसरे को छू तो नहीं रहे हैं? यदि छू रहे हों तो उन्हें एक-दूसरे से दूर-दूर करना पड़ेगा।
- परिपथ पूरा करने के लिए जिंक की पट्टी और तांबे के एनोड के साथ जो तार के जोड़ बने हैं वे कहीं अम्ल में तो नहीं डूब गए हैं या जोड़ गीले तो नहीं हो गए हैं? यदि ऐसा हुआ है तो जोड़ को बाहर निकालना होगा।
सेल तो आसानी से बन गया। लेकिन सेल को बनाते समय कुछ सवाल ज़रूर उठे होंगे जैसे, सेल बिजली कैसे बनाता है, एनोड-कैथोड की क्या भूमिका है, और यदि हमने सेल बनाया है; तो बैटरी, सेल से अलग कैसे होती है?
कैसे बनती है बिजली
सेल या बैटरी एक ऐसा तरीका है जिससे रासायनिक ऊर्जा को विद्युत ऊर्जा में बदला जाता है। सेल या बैटरी में सामान्यतः धन और ऋण ध्रुव के अलावा कुछ रसायन भरे जाते हैं जिनकी आपस में क्रिया होती है, जिससे विद्युत धारा बनती है और परिपथ में से होकर बहती है। सेल में दो ध्रुव होते हैं जिन्हें धन और ऋण ध्रुव कहा जाता है। यह दोनों धारा के बहाव के काम आते हैं और इन दोनों का विद्युत परिपथ में जुड़ा होना धारा बहने की एक अनिवार्य शर्त है।
सेलों में ध्रुव धातु या कार्बन के बने होते हैं और उनका आकार भिन्न-भिन्न हो सकता है। ये ध्रुव एक-दूसरे से दूर होते हैं और उनके बीच का स्थान रासायनिक पदार्थों से भरा होता है। यह रासायनिक पदार्थ आपस में क्रिया करते हैं और विद्युत धारा का प्रवाह ऋण ध्रुव से धन ध्रुव की ओर बाहरी परिपथ की सहायता से होता है।
सेल में भरे जाने वाले रासायनिक पदार्थ इलेक्ट्रोलाइट कहलाते हैं। इलेक्ट्रोलाइट वे यौगिक हैं जिनको बनाने वाले अणुओं में इलेक्ट्रॉनों का आदान प्रदान होता है। नमक ( सोडियम क्लोराइड ) भी एक इलेक्ट्रोलाइट है। सोडियम का परमाणु एक इलेक्ट्रॉन देता है और क्लोरीन का परमाणु उसे ले लेता है और दोनों आयन जुड़कर सोडियम क्लोराइड यानी नमक का एक अणु बनाते हैं। जब इस इलेक्ट्रोलाइट को पानी में डालते हैं तो पानी इनके परमाणुओं के बीच के जुड़ाव को कम कर देता है और यह इलेक्ट्रोलाइट आयनित हो जाता है यानी सोडियम और क्लोराइड आयन अलग-अलग हो जाते हैं। इलेक्ट्रोलाइट की इसी विशेषता का उपयोग सेल या बैटरी में किया जाता है।
ऊपर बताई गई बातें काफी उलझन भरी लग सकती हैं। इसलिए इन बातों को एक साधारण टॉर्च सेल की सहायता
से समझने की कोशिश करें तो शायद आसानी होगी।
बर्तन के अंदर क्या है?
टॉर्च सेल में एक ध्रुव तो कार्बन की छड़ है और दूसरा ध्रुव जिंक का वह बर्तन है जिसमें सब कुछ भरा हुआ है। इस बर्तन के ऊपर चढ़ा है गत्ते का एक मोटा आवरण जिस पर कम्पनी का नाम वगैरह लिखा होता है।
जिंक के बर्तन के अंदर चारों ओर उससे छूती हुई एक कागज़ की जाली होती है। वैसे ही रखे हुए सेल में (जो अभी परिपथ से नहीं जुड़ा है) यह कागज़ की जाली अंदर के रसायनों और जस्ते के खोल के बीच रासायनिक क्रिया नहीं होने देती। इस तरह धारा के व्यर्थ प्रवाह को रोकने में मदद मिलती है। कागज़ की जाली के बाद होती है इलेक्ट्रोलाइट की पेस्ट (दांत साफ करने वाले पेस्ट की तरह )। इलेक्ट्रोलाइट की पेस्ट अमोनियम क्लोराइड व जिंक क्लोराइड को पानी के साथ मिलाकर बनाई जाती है। इस इलेक्ट्रोलाइट पेस्ट और कार्बन की छड़
 शुष्क सेल की बनाबटः (1) सेल के चारों ओर कागज़ का खोल। (2) कागज़ के घोल के बाद लगा जस्ते का एक बर्तन - यह कैथोड का काम करता है। (3) इलेक्ट्रोलाइट ( अमोनियम क्लोराइड ) की लेई, जो जस्ते के बर्तन के बाद भरी होती है। इन सबके अलावा कार्बन की छड़ (5), जो एनोड का काम करती है, के आसपास मैगनीज़ डाइऑक्साड(4) का सूखा पाउडर भी भरा रहता है। इस सेल में जस्ते के बर्तन से कार्बन की छड़ की ओर बिजली की धारा बहती है जो बाहरी परिपथ पूरा होने पर हमें मिलती है।
शुष्क सेल की बनाबटः (1) सेल के चारों ओर कागज़ का खोल। (2) कागज़ के घोल के बाद लगा जस्ते का एक बर्तन - यह कैथोड का काम करता है। (3) इलेक्ट्रोलाइट ( अमोनियम क्लोराइड ) की लेई, जो जस्ते के बर्तन के बाद भरी होती है। इन सबके अलावा कार्बन की छड़ (5), जो एनोड का काम करती है, के आसपास मैगनीज़ डाइऑक्साड(4) का सूखा पाउडर भी भरा रहता है। इस सेल में जस्ते के बर्तन से कार्बन की छड़ की ओर बिजली की धारा बहती है जो बाहरी परिपथ पूरा होने पर हमें मिलती है।
के बीच मैगनीज़ डाई ऑक्साइड पाउडर भरा रहता है। इस 'खज़ाने' से भरे जिंक के बर्तन को ऊपर से कोलतार से सील किया होता है।
अब देखें इस सेल में धारा कैसे पैदा होती है। सेल में जिंक का बरतन ( ऋण ध्रुव) अमोनियम क्लोराइड की गीली पेस्ट से क्रिया करके जिंक आयन बनाता है। इस क्रिया के कारण दो इलेक्ट्रॉन मुक्त होते हैं जो सेल के बाहर के परिपथ से होते हुए कार्बन की छड़ ( धन ध्रुव ) तक पहुंचते हैं। यहां मैंगनीज डाइऑक्साइड इन इलेक्ट्रॉनों को ग्रहण करता है। दो इलेक्ट्रॉनों को पाने के बाद यहां भी रासायनिक क्रिया होती है जिसमें पानी भी शामिल होता है और OH– आयन बनते हैं। OH– आयन कागज़ की जाली को पार करके अमोनियम क्लोराइड से क्रिया कर अमोनिया गैस बनाते हैं।
यह रासायनिक क्रिया बीच में रुक भी सकती है; अगर बाहरी परिपथ में किसी तरह की कमी हो या परिपथ टूटा हो तो इलेक्ट्रॉन आगे नहीं जा पाएंगे जिससे वे धीरे-धीरे जिंक के खोल पर इकट्ठे होने लगेंगे और जिंक की अमोनियम क्लोराइड से क्रिया रुक जाएगी। जब परिपथ पूरा होगा तो जिंक फिर से अमोनियम क्लोराइड से क्रिया करने लगता है और विद्युत धारा फिर बहने लगती है। इस सेल में धारा के बहने के लिए जिंक से जिंक क्लोराइड बनना और मैंगनीज डाइऑक्साइड (MnO2) से Mn2O3 बनना आवश्यक है।
2MnO2+H2O+2e– = Mn2O3+2OH–
यानी जब हम सेल से बल्ब जलाते हैं तो जिंक घुलकर इलेक्ट्रॉन बना रहा होता है और मैगनीज़ डाई ऑक्साइड इन इलेक्ट्रॉनों को खाकर परिपथ पूरा करता है।
इसी तरह के कई और सेल होते हैं जिनमें दो ध्रुवों में से एक ध्रुव क्रिया करके इलेक्ट्रॉन स्वतंत्र करता है और ये इलेक्ट्रॉन दूसरे ध्रुव पर चले जाते हैं।
प्राइमरी सेल
इस प्रकार के सेल को प्राइमरी सेल कहते हैं। इनमें रासायनिक पदार्थ में उपलब्ध ऊर्जा और रासायनिक क्रिया की गति के अनुसार विद्युत धारा पैदा होती है और रासायनिक पदार्थ धीरे धीरे समाप्त होते जाते हैं। अंततः सेल काम करना बंद कर देता है।
सेल में खत्म हो गए रासायनिक पदार्थों को बदलकर नए रसायन डाल पाना सम्भव नहीं है और सेलों को चार्ज कर पाना भी सम्भव नहीं होता। टॉर्च, ट्रांजिस्टर, दीवार घड़ी, कैलकुलेटर और खिलौनों में आमतौर पर इसी तरह के प्रायमरी सेल उपयोग में लाए जाते हैं।
सेकेंडरी सेल
 प्राथमिक सेलों में बार-बार रसायन बदल पाना सम्भव नहीं होता है तथा रसायन खत्म होने के साथ धारा की शक्ति भी कम होती जाती है। इन कमियों को दूर करने के लिए ही सेकेंडरी सेलों का विकास हुआ। इस तरह का सेल जब विद्युत धारा देना बंद कर देता है तो यह कहा जाता है कि सेल डिस्चार्ज हो गया है। डिस्चार्ज हो गए सेल में उल्टी दिशा में विद्युत धारा प्रवाहित की जाती है ताकि सेल में उपस्थित रासायनिक पदार्थ अपनी पहले वाली स्थिति में आ जाएं। यानी कि सेकेंडरी सेल के खत्म हो जाने के बाद भी उसे फिर से चार्ज किया जा सकता है। पेचीदा-सी लगने वाली बातों को लेड एसिड बैटरी के उदाहरण से समझने की कोशिश करते हैं, जो एक सेकेंडरी सेल है।
प्राथमिक सेलों में बार-बार रसायन बदल पाना सम्भव नहीं होता है तथा रसायन खत्म होने के साथ धारा की शक्ति भी कम होती जाती है। इन कमियों को दूर करने के लिए ही सेकेंडरी सेलों का विकास हुआ। इस तरह का सेल जब विद्युत धारा देना बंद कर देता है तो यह कहा जाता है कि सेल डिस्चार्ज हो गया है। डिस्चार्ज हो गए सेल में उल्टी दिशा में विद्युत धारा प्रवाहित की जाती है ताकि सेल में उपस्थित रासायनिक पदार्थ अपनी पहले वाली स्थिति में आ जाएं। यानी कि सेकेंडरी सेल के खत्म हो जाने के बाद भी उसे फिर से चार्ज किया जा सकता है। पेचीदा-सी लगने वाली बातों को लेड एसिड बैटरी के उदाहरण से समझने की कोशिश करते हैं, जो एक सेकेंडरी सेल है।
लेड ऐसिड बैटरी
लेड ऐसिड बैटरी का उपयोग कार या बसों में लगने वाली बैटरी में होता है। इस बैटरी में लेड़ और लेड-डाइऑक्साइड के ध्रुव होते हैं। इन के बीच इलेक्ट्रोलाइट के रूप में गंधक का अम्ल होता है। यहां एक बात महत्वपूर्ण है कि मोटर-कार में लगा डायनमो चलती हुई कार में लगातार बिजली पैदा करता रहता है और बैटरी को देता है। जिससे बैटरी हमेशा चार्ज होती रहती है।
जब लेड ऐसिड बैटरी से बिजली लेते हैं तो उसका लेड, गंधक के अम्ल के सल्फेट से क्रिया करके लेड सल्फेट और इलेक्ट्रॉन बनाता है।
Pb + SO42– = PbSO4 + 2e–
दूसरा लेड-डाइऑक्साइड का ध्रुव इन इलेक्ट्रॉनों को लेने के लिए तैयार रहता
PbO2 + 4H+ + SO42– + 2e– = PbSO4 +2H2O
जब सारा लेड, लेङ-सल्फेट में बदल जाता है तो बैटरी डिस्चार्ज हो जाती है। अब इस तरह की बैटरी को बाहर से इलेक्ट्रॉन देकर चार्ज किया जा सकता है। चार्ज करते समय बैटरी चार्जर, लेड़ सल्फेट के दोनों इलेक्ट्रोडों में से एक को
लेड और दूसरे को लेड-डाइ-ऑक्साइड में बदल देता है। इस तरह बैटरी फिर से अपनी पहले वाली स्थिति में वापस आ जाती है।
सेल-बैटरी, फ़र्क थोड़ा-सा
अब तक हमने खुद एक सेल बनाकर देखा और प्राइमरी-सेकेंडरी सेल के बारे में जानने की कोशिश की। लेकिन एक बात फिर भी रह गई कि सेल और बैटरी में क्या अंतर है? जैसा कि अब तक हमने देखा है कि सेल बिजली पैदा करने की एक इकाई है जिसमें धन और ऋण ध्रुव का एक जोड़ा ज़रूर होता है। बैटरी में एक से ज्यादा सेल होते हैं। यानी धन और ऋण ध्रुव के जोड़े भी एक से ज्यादा होंगे। या हम यह भी कह सकते हैं कि सेल एक इकाई है तो बैटरी एक समूह है।
प्रायः बोलचाल में हम इस फ़र्क का खास ध्यान नहीं रख पाते हैं और टॉर्च ट्रांजिस्टर में लगने वाले सेल को भी बैटरी कहते हैं और कार आदि में लगने वाले काले डिब्बे को भी बैटरी कह कर ही पुकारते हैं।
(प्रमोद उपाध्याय - नेशनल इंस्टिट्यूट ऑफ इम्यूनोलॉजी, दिल्ली में शोधरत्। दिल्ली विश्वविद्यालय के साइंस एजुकेशन सेंटर के साथ महंगे व जटिल उपकरणों के सरल विकल्पों के विकास में सक्रिय।)