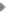कोकिल चौधरी
 नाबेल पुरस्कार एक अत्यन्त प्रतिष्ठित पुरस्कार है जो अल्फ्रेड नोबेल के नाम पर दिया जाता है। नोबेल एक स्वीडिश वैज्ञानिक थे। उनकी वसीयत में पाँच अलग-अलग क्षेत्रों में पुरस्कारों की स्थापना की गई थी। आजकल ये पुरस्कार 6 अलग-अलग विषयों में हर वर्ष स्वीडिश और नॉर्वेजियन संस्थाओं द्वारा दिए जाते हैं: चिकित्सा/कार्यिकी, भौतिक शास्त्र, रसायन शास्त्र, शान्ति, साहित्य और अर्थ शास्त्र। इस लेख में वर्ष 2018 में प्रदान किए तीन पुरस्कारों की चर्चा की गई है: चिकित्सा/कार्यिकी, भौतिक शास्त्र और रसायन शास्त्र।
नाबेल पुरस्कार एक अत्यन्त प्रतिष्ठित पुरस्कार है जो अल्फ्रेड नोबेल के नाम पर दिया जाता है। नोबेल एक स्वीडिश वैज्ञानिक थे। उनकी वसीयत में पाँच अलग-अलग क्षेत्रों में पुरस्कारों की स्थापना की गई थी। आजकल ये पुरस्कार 6 अलग-अलग विषयों में हर वर्ष स्वीडिश और नॉर्वेजियन संस्थाओं द्वारा दिए जाते हैं: चिकित्सा/कार्यिकी, भौतिक शास्त्र, रसायन शास्त्र, शान्ति, साहित्य और अर्थ शास्त्र। इस लेख में वर्ष 2018 में प्रदान किए तीन पुरस्कारों की चर्चा की गई है: चिकित्सा/कार्यिकी, भौतिक शास्त्र और रसायन शास्त्र।
चिकित्सा/कार्यिकी
इस क्षेत्र में 2018 का नोबेल पुरस्कार एक निहायत महत्वपूर्ण व समग्र अध्ययन के लिए दिया गया है: कैंसर के उपचार में इम्यूनोथेरपी (प्रतिरक्षा-आधारित उपचार) का इस्तेमाल। यह न सिर्फ कैंसर बल्कि उस तरह की अन्य बीमारियों के उपचार में वरदान साबित होगा। पुरस्कार की राशि यूएसए के जेम्स पी. एलीसन और जापान के तासुको होनजो के बीच बराबर-बराबर बाँटी गई है।
फिलहाल कैंसर को एक लाइलाज बीमारी माना जाता है क्योंकि यह कोई एक बीमारी न होकर कई व्याधियों का मिला-जुला असर होता है। यह शरीर के किसी भी अंग में पनप सकता है और किसी भी अंग को प्रभावित कर सकता है। फिलहाल इस रोग के कारण पैदा होने वाले लक्षणों का ही उपचार किया जाता है, स्वयं इस बीमारी का नहीं। कैंसर के उपचार के लिए मुख्य रूप से तीन तरीकों का उपयोग किया जाता है: सर्जरी, विकिरण और कीमोथेरपी। निश्चित रूप से इसके उपचार के लिए किसी अधिक सूक्ष्म व सटीक विधि की ज़रूरत है। 2018 में नोबेल पुरस्कार से सम्मानित खोज व अध्ययन के महत्व को समझने के लिए पहले हमें अपनी प्रतिरक्षा प्रणाली को समझना होगा।
 हमारे शरीर में किसी भी ऊतक का आकार उसमें उपस्थित कोशिकाओं के आकार और संख्या से निर्धारित होता है। यह पूरी प्रक्रिया काफी व्यवस्थित होती है और सख्त नियम-कायदों के तहत चलती है। यह तो पक्की बात है कि हमारे शरीर की कोशिकाएँ इन वृद्धि नियमों के अनुसार ही विभाजन करती हैं। अलबत्ता, कुछ कोशिकाएँ इन नियंत्रणों से बच जाती हैं और निरंकुश ढंग से विभाजन करने लगती हैं, जिसकी वजह से गठान (यानी ट्यूमर) पैदा हो जाती है। आगे चलकर ये कोशिकाएँ अन्य ऊतकों में पहुँच जाती हैं और वहाँ की निवासी बन जाती हैं। कैंसर के निर्माण और फैलने (मेटास्टेसिस) की बुनियादी प्रक्रिया यही है।
हमारे शरीर में किसी भी ऊतक का आकार उसमें उपस्थित कोशिकाओं के आकार और संख्या से निर्धारित होता है। यह पूरी प्रक्रिया काफी व्यवस्थित होती है और सख्त नियम-कायदों के तहत चलती है। यह तो पक्की बात है कि हमारे शरीर की कोशिकाएँ इन वृद्धि नियमों के अनुसार ही विभाजन करती हैं। अलबत्ता, कुछ कोशिकाएँ इन नियंत्रणों से बच जाती हैं और निरंकुश ढंग से विभाजन करने लगती हैं, जिसकी वजह से गठान (यानी ट्यूमर) पैदा हो जाती है। आगे चलकर ये कोशिकाएँ अन्य ऊतकों में पहुँच जाती हैं और वहाँ की निवासी बन जाती हैं। कैंसर के निर्माण और फैलने (मेटास्टेसिस) की बुनियादी प्रक्रिया यही है।
अति-विभाजन और नए-नए ऊतकों में बसने की इसी प्रक्रिया का उपयोग बैक्टीरिया और वायरस जैसे संक्रामक सूक्ष्मजीव भी करते हैं। चूँकि ये सूक्ष्मजीव पराए होते हैं और हमारी अपनी कोशिकाओं जैसे नज़र नहीं आते, इसलिए हमारे शरीर का प्रतिरक्षा तंत्र इन्हें एक सम्भावित खतरे के रूप में पहचानकर इनका सफाया करने में सक्षम होता है। इस सुरक्षा का एक प्रमुख औज़ार टी-कोशिका नामक श्वेत रक्त कोशिकाएँ होती हैं। ये इस प्रतिरक्षा का एक महत्वपूर्ण हिस्सा हैं। आम तौर पर बाहर से शरीर में प्रवेश करने वाले बैक्टीरिया पर कुछ एंटीजेन होते हैं, जिनसे प्रतिरक्षा तंत्र को यह जानने में मदद मिलती है कि वह बैक्टीरिया अपना नहीं बल्कि पराया है। टी-कोशिका पर उपस्थित ग्राही अन्य प्रतिरक्षा कोशिकाओं को सक्रिय कर देते हैं।
लेकिन कैंसर तो हमारी अपनी कोशिकाओं से बनता है। इसलिए हमारा प्रतिरक्षा तंत्र उन्हें शरीर के लिए खतरे के रूप में नहीं पहचान पाता। इसी वजह से ये कैंसर कोशिकाएँ पहचानी जाकर, सफाए से बच निकलती हैं। किसी प्रकार से यदि हम अपनी प्रतिरक्षा कोशिकाओं में ऐसे बदलाव कर दें कि वे हमारी अपनी कैंसर कोशिकाओं को खतरे के रूप में पहचानने लगें तो कैसा रहे? क्या ऐसा करके हम अपनी प्रतिरक्षा कोशिकाओं को शरीर की कैंसर कोशिकाओं को हटाने के लिए सक्रिय कर पाएँगे? इस विचार के साथ जेम्स पी. एलीसन और तासुको होनजो, दोनों ने कई वर्षों तक चूहे के ट्यूमर को मॉडल के रूप में लेकर काम किया। वे टी-कोशिकाओं को सक्रिय करके चूहों में विभिन्न किस्म के कैंसर का उपचार करने में सफल रहे।
 यदि हम अपनी प्रतिरक्षा पर सरसरी नज़र डालें तो पता चलता है कि जब हमारी प्रतिरक्षा कोशिकाओं को लगता है कि कोई बाहरी तत्व मौजूद है, तो वे उस बाहरी तत्व के साथ-साथ अपनी संख्या भी बढ़ाने लगती हैं। यदि यह संख्या बहुत ज़्यादा हो जाए तो वे हमारी सामान्य कोशिकाओं के लिए भी हानिकारक हो जाती हैं। इसके परिणामस्वरूप कई बीमारियाँ पैदा होती हैं जिन्हें आत्म-प्रतिरक्षा (ऑटो-इम्यून) रोग कहते हैं। ऐसी अनियंत्रित संख्या-वृद्धि से बचाव के लिए हमारी प्रतिरक्षा कोशिकाओं की सतह पर कुछ स्विच या ब्रेक होते हैं। हमारी सामान्य कोशिकाएँ इन स्विचों की मदद से प्रतिरक्षा कोशिकाओं को काम करने से रोकती हैं। कैंसर कोशिकाएँ भी इसी प्रकार के स्विच या ब्रेक का उपयोग करके प्रतिरक्षा कोशिकाओं को काम करने से रोकती हैं। जेम्स पी. एलीसन और तासुको होनजो ने इस विचार पर काम करते हुए दो ऐसे स्विच खोजे हैं जो प्रतिरक्षा तंत्र पर ब्रेक का काम करते हैं। इन दो स्विच के नाम हैं: सायटोटॉक्सिक टी-लिम्फोसाइट एंटीजेन-4 (CTLA-4) और प्रोग्राम्ड सेल डेथ-1 (PD-1)।
यदि हम अपनी प्रतिरक्षा पर सरसरी नज़र डालें तो पता चलता है कि जब हमारी प्रतिरक्षा कोशिकाओं को लगता है कि कोई बाहरी तत्व मौजूद है, तो वे उस बाहरी तत्व के साथ-साथ अपनी संख्या भी बढ़ाने लगती हैं। यदि यह संख्या बहुत ज़्यादा हो जाए तो वे हमारी सामान्य कोशिकाओं के लिए भी हानिकारक हो जाती हैं। इसके परिणामस्वरूप कई बीमारियाँ पैदा होती हैं जिन्हें आत्म-प्रतिरक्षा (ऑटो-इम्यून) रोग कहते हैं। ऐसी अनियंत्रित संख्या-वृद्धि से बचाव के लिए हमारी प्रतिरक्षा कोशिकाओं की सतह पर कुछ स्विच या ब्रेक होते हैं। हमारी सामान्य कोशिकाएँ इन स्विचों की मदद से प्रतिरक्षा कोशिकाओं को काम करने से रोकती हैं। कैंसर कोशिकाएँ भी इसी प्रकार के स्विच या ब्रेक का उपयोग करके प्रतिरक्षा कोशिकाओं को काम करने से रोकती हैं। जेम्स पी. एलीसन और तासुको होनजो ने इस विचार पर काम करते हुए दो ऐसे स्विच खोजे हैं जो प्रतिरक्षा तंत्र पर ब्रेक का काम करते हैं। इन दो स्विच के नाम हैं: सायटोटॉक्सिक टी-लिम्फोसाइट एंटीजेन-4 (CTLA-4) और प्रोग्राम्ड सेल डेथ-1 (PD-1)।
 जेम्स पी. एलीसन ने विशिष्ट रूप से CTLA-4 पर काम किया। वे ऐसी एंटीबॉडी तो पहले ही विकसित कर चुके थे जो CTLA-4 से जुड़कर उसके काम को बाधित कर सकती थी। इसके साथ ही तासुको होनजो ने PD-1 की खोज की। यह भी एक प्रोटीन है जो टी-सेल की सतह पर प्रकट होता है। इसका सावधानीपूर्वक उपयोग करने के बाद यह पता चला कि यह सीटीएलए-4 के समान टी-सेल के लिए ब्रेक का काम भी करता है, हालाँकि इसकी क्रियाविधि उससे भिन्न होती है। लिहाज़ा, इन क्रियाविधियों का उपयोग करके कैंसर के लिए भविष्य में प्रतिरक्षा उपचार लाभदायक हो सकता है।
जेम्स पी. एलीसन ने विशिष्ट रूप से CTLA-4 पर काम किया। वे ऐसी एंटीबॉडी तो पहले ही विकसित कर चुके थे जो CTLA-4 से जुड़कर उसके काम को बाधित कर सकती थी। इसके साथ ही तासुको होनजो ने PD-1 की खोज की। यह भी एक प्रोटीन है जो टी-सेल की सतह पर प्रकट होता है। इसका सावधानीपूर्वक उपयोग करने के बाद यह पता चला कि यह सीटीएलए-4 के समान टी-सेल के लिए ब्रेक का काम भी करता है, हालाँकि इसकी क्रियाविधि उससे भिन्न होती है। लिहाज़ा, इन क्रियाविधियों का उपयोग करके कैंसर के लिए भविष्य में प्रतिरक्षा उपचार लाभदायक हो सकता है।
भौतिकी
भौतिकी के 2018 के नोबेल पुरस्कार का सम्बन्ध लेज़र टक्नोलॉजी और उसके उपयोग से है जिसके आधार पर प्रकाश-आधारित सूक्ष्म औज़ार बनाए जा सकेंगे। पुरस्कार का एक हिस्सा उस उपकरण के लिए दिया गया है जिसका उपयोग कणों को कैद करने के लिए किया जा सकता है। पुरस्कार का दूसरा हिस्सा उस तकनीक के लिए दिया गया है जो पल्स लेज़र को ज़्यादा तीव्र और तेज़ बना देती है। इसके फलस्वरूप उच्च तीव्रता के अति सूक्ष्म अवधि के प्रकाशीय स्पन्दन पैदा किए जा सकते हैं। पहले माना जाता था कि यह असम्भव है। 2018 का पुरस्कार यूएस के आर्थर एशकिन (जो 96 वर्ष की उम्र में नोबेल पुरस्कार पाने वाले सबसे बुज़ुर्ग वैज्ञानिक हैं), फ्रांस के जेरार्ड मोरो और कनाडा की डोना स्ट्रिकलैंड को दिया गया है।
सामान्य प्रकाश कई तरंग लम्बाइयों का मिश्रण होता है जो अलग तीव्रताओं और अलग-अलग दिशाओं में गति करती हैं। लेज़र एक विशेष किस्म का प्रकाश उत्पन्न करता है जिसकी तरंग लम्बाइयाँ, तीव्रताएँ और दिशाएँ एकदम एक समान होती हैं। आर्थर एशकिन अपने विचार पर तब से काम कर रहे हैं जब 1960 में पहला लेज़र निर्मित किया गया था। उन्होंने ‘प्रकाशीय चिमटियों’ का आविष्कार किया है। इसमें अत्यन्त फोकस्ड लेज़र पुंज के दबाव का उपयोग किया जाता है और इसकी मदद से सूक्ष्म वस्तुओं को पकड़ा जाता है और इधर-उधर हिलाया-डुलाया जाता है। इनमें वायरस और बैक्टीरिया जैसे सजीव कण भी शामिल हैं। इसकी मदद से प्रोटीन, डीएनए और कोशिकाओं के आन्तरिक हिस्सों की प्रक्रियाओं का अध्ययन किया जा सकता है।
सत्रहवीं सदी की शुरुआत में जोहानेस केपलर ने सुझाया था कि जिस तरह पानी की एक तेज़ धार वस्तुओं को हिला-डुला सकती है, उसी तरह प्रकाश की किरणों के दबाव का इस्तेमाल भी वस्तुओं को सरकाने के लिए किया जा सकता है। लेज़र के आविष्कार के साथ ही आर्थर एशकिन ने समझ लिया था कि यह उपकरण ऐसा प्रकाश उत्पन्न कर सकता है जिसकी दिशा व तीव्रता निश्चित होगी और उसका उपयोग वस्तुओं को सरकाने में किया जा सकेगा। लेज़र पुंज को छोटी-छोटी वस्तुओं पर लक्षित करके वे यह दिखाने में सफल रहे कि वे वस्तुओं को निर्धारित गति से सरका सकते हैं।
प्रकाशीय चिमटियों का उपयोग कई तरह से किया जाता है। सबसे पहला तो यह है कि कई शोधकर्ता इस तकनीक का उपयोग परमाणुओं और अणुओं को पकड़कर रखने के लिए करते हैं ताकि उनका अध्ययन किया जा सके। एशकिन ने अवरक्त प्रकाश लेज़र का उपयोग वायरस, बैक्टीरिया और जीवित कोशिकाओं का अध्ययन करने हेतु किया और इस दौरान इन्हें कोई क्षति नहीं पहुँची और न ही उनकी कार्यिकी में कोई परिवर्तन हुआ। आजकल इस विधि का उपयोग उन क्षेत्रों में किया जाता है जहाँ शोधकर्ता छोटी-छोटी वस्तुओं - जैसे डीएनए के अणु, वायरस और बैक्टीरिया - की जाँच करना चाहते हैं।
पुरस्कार का शेष आधा हिस्सा जेरार्ड मोरो और डोना स्ट्रिकलैंड को संयुक्त रूप से दिया गया है। उन्हें यह सम्मान उच्च तीव्रता के अति-सूक्ष्म अवधि के प्रकाश स्पन्दन पैदा करने के लिए दिया गया। पाँच साल पहले मारिया जियोफर्टे मेयर को नोबेल पुरस्कार प्रदान किया गया था। उनके बाद स्ट्रिकलैंड भौतिकी का नोबेल पुरस्कार प्राप्त करने वाली तीसरी महिला हैं।
 लेज़र का एक अन्य उपयोग प्रकाशीय स्पन्दन पैदा करने में है। प्रकाशीय स्पन्दन का अर्थ है अन्य स्रोतों की अपेक्षा प्रकाश की एक उच्च तीव्रता वाला संकेत जो बहुत कम समय अन्तराल के लिए हो। 1980 के दशक के मध्य तक बहुत तीव्रता के लेज़र पुंज पैदा करना सम्भव नहीं था क्योंकि लेज़र उपकरण गर्म होकर बरबाद हो जाता था। इस समस्या को सुलझाने के लिए डोना स्ट्रिकलैंड और जेरार्ड मोरो ने एक तकनीक विकसित की जिसे चर्प्ड (chirped) पल्स एम्प्लीफिकेशन या सीपीए कहते हैं। उन्होंने प्रकाश की तीव्रता आवर्धन के लिए प्रयुक्त पदार्थ को नुकसान पहुँचाए बगैर उच्च तीव्रता का अति-सूक्ष्म अवधि लेज़र स्पन्दन हासिल किया। इस तकनीक में लेज़र उपकरण में प्रिज़्म, प्रकाशीय तन्तु (ऑप्टिकल फाइबर) और दर्पणों का मिला-जुला उपयोग करके तीव्रता बढ़ाई जाती है। उपकरण मूलत: तीन चरणों में काम करता है। पहले चरण में अपेक्षाकृत मानक लेज़र स्पन्दन निर्मित किया जाता है। इसके बाद स्पन्दन के समय को लम्बा किया जाता है जिससे उसकी सर्वोच्च शक्ति कम हो जाती है। ऐसा करने पर वह स्पन्दन पदार्थ के लिए कम विनाशकारी हो जाता है। अगले चरण में उन्होंने समय-विस्तीर्ण, कम शक्ति वाले स्पन्दन का आवर्धन किया और ऐसा करते हुए उन्हें आवर्धन करने वाले माध्यम के नष्ट होने की बहुत ज़्यादा चिन्ता नहीं करनी पड़ी। अन्तत: आवर्धित स्पन्दन को वापिस सम्पीड़ित यानी कम्प्रेस कर दिया गया। जब पुंज को फिर से बढ़ाया गया तो उच्च तीव्रता के लेज़र प्रकाश का अत्यन्त ऊर्जावान विस्फोट पैदा हुआ। यह विस्फोट समय के मान से एक एटोसेकण्ड (10-18 सेकण्ड) के अन्तराल का था।
लेज़र का एक अन्य उपयोग प्रकाशीय स्पन्दन पैदा करने में है। प्रकाशीय स्पन्दन का अर्थ है अन्य स्रोतों की अपेक्षा प्रकाश की एक उच्च तीव्रता वाला संकेत जो बहुत कम समय अन्तराल के लिए हो। 1980 के दशक के मध्य तक बहुत तीव्रता के लेज़र पुंज पैदा करना सम्भव नहीं था क्योंकि लेज़र उपकरण गर्म होकर बरबाद हो जाता था। इस समस्या को सुलझाने के लिए डोना स्ट्रिकलैंड और जेरार्ड मोरो ने एक तकनीक विकसित की जिसे चर्प्ड (chirped) पल्स एम्प्लीफिकेशन या सीपीए कहते हैं। उन्होंने प्रकाश की तीव्रता आवर्धन के लिए प्रयुक्त पदार्थ को नुकसान पहुँचाए बगैर उच्च तीव्रता का अति-सूक्ष्म अवधि लेज़र स्पन्दन हासिल किया। इस तकनीक में लेज़र उपकरण में प्रिज़्म, प्रकाशीय तन्तु (ऑप्टिकल फाइबर) और दर्पणों का मिला-जुला उपयोग करके तीव्रता बढ़ाई जाती है। उपकरण मूलत: तीन चरणों में काम करता है। पहले चरण में अपेक्षाकृत मानक लेज़र स्पन्दन निर्मित किया जाता है। इसके बाद स्पन्दन के समय को लम्बा किया जाता है जिससे उसकी सर्वोच्च शक्ति कम हो जाती है। ऐसा करने पर वह स्पन्दन पदार्थ के लिए कम विनाशकारी हो जाता है। अगले चरण में उन्होंने समय-विस्तीर्ण, कम शक्ति वाले स्पन्दन का आवर्धन किया और ऐसा करते हुए उन्हें आवर्धन करने वाले माध्यम के नष्ट होने की बहुत ज़्यादा चिन्ता नहीं करनी पड़ी। अन्तत: आवर्धित स्पन्दन को वापिस सम्पीड़ित यानी कम्प्रेस कर दिया गया। जब पुंज को फिर से बढ़ाया गया तो उच्च तीव्रता के लेज़र प्रकाश का अत्यन्त ऊर्जावान विस्फोट पैदा हुआ। यह विस्फोट समय के मान से एक एटोसेकण्ड (10-18 सेकण्ड) के अन्तराल का था।
दुनिया भर में उच्च शक्ति वाले लेज़र अपने पुंज में ऊर्जा में वृद्धि के लिए इसी तकनीक का उपयोग करते हैं। स्पन्दित लेज़र के विभिन्न क्षेत्रों में तमाम उपयोग हैं। इनमें चिकित्सा (जैसे आँखों की सुधारात्मक सर्जरी और सम्भवत: कैंसर का उपचार), सेना (जैसे लेज़र दृष्टि और लेज़र लक्ष्य-निर्धारण), और उद्योग (लेज़र तराश, वेल्डिंग और ड्रिलिंग) शामिल हैं। सुपरमार्केट में बारकोड रीडर भी लेज़र-आधारित होते हैं।
रसायन शास्त्र
2018 के रसायन नोबेल का आधा हिस्सा फ्रांसिस एच. अनाîल्ड को एंज़ाइम के प्रत्यक्ष विकास हेतु दिया गया है। शेष आधा हिस्सा संयुक्त रूप से जॉर्ज पी. स्मिथ और सर ग्रेगरी पी. विंटर को पेप्टाइड व एंटीबॉडी पर शोध के लिए मिला है। इन शोध कार्यों ने मोनोलोनल एंटीबॉडीज़ जैसी औषधियों के उत्पादन को नई दिशा दी है।
 पहले तो इनके पीछे की बुनियादी बातों को समझ लेते हैं। मानव जीनोम में डीएनए होता है। इस डीएनए में हमारे सारे जीन्स होते हैं। जीन डीएनए अणु का एक हिस्सा होता है जो किसी प्रोटीन की संरचना का कोड होता है। प्रोटीन अमीनो अम्लों से मिलकर बने होते हैं, और जीन यह तय करता है कि कौन-से अमीनो अम्ल किस क्रम में जुड़कर कोई प्रोटीन बनाएँगे। एंज़ाइम महत्वपूर्ण प्रोटीन होते हैं जो सजीवों में सम्पादित होने वाली अधिकांश रासायनिक क्रियाओं का नियंत्रण व समन्वय करते हैं। इस प्रकार से, जीन किसी जीव के गुणधर्म का निर्धारण करते हैं। कभी-कभार डीएनए अणु में परिवर्तन की वजह से जीवों के जीन्स में उत्परिवर्तन हो जाते हैं। जब ऐसे परिवर्तन जीव के लिए सकारात्मक होते हैं, तो वह अपने परिवेश में बेहतर ढंग से काम करता है। किन्तु यदि यह उत्परिवर्तन जीव को नकारात्मक ढंग से प्रभावित करता है तो अक्सर वह जीव असमय मृत्यु को प्राप्त होता है। इस तरह से किसी प्रजाति के गुणधर्म क्रमश: उन्नत होते जाते हैं किन्तु यह बहुत धीमी प्रक्रिया होती है।
पहले तो इनके पीछे की बुनियादी बातों को समझ लेते हैं। मानव जीनोम में डीएनए होता है। इस डीएनए में हमारे सारे जीन्स होते हैं। जीन डीएनए अणु का एक हिस्सा होता है जो किसी प्रोटीन की संरचना का कोड होता है। प्रोटीन अमीनो अम्लों से मिलकर बने होते हैं, और जीन यह तय करता है कि कौन-से अमीनो अम्ल किस क्रम में जुड़कर कोई प्रोटीन बनाएँगे। एंज़ाइम महत्वपूर्ण प्रोटीन होते हैं जो सजीवों में सम्पादित होने वाली अधिकांश रासायनिक क्रियाओं का नियंत्रण व समन्वय करते हैं। इस प्रकार से, जीन किसी जीव के गुणधर्म का निर्धारण करते हैं। कभी-कभार डीएनए अणु में परिवर्तन की वजह से जीवों के जीन्स में उत्परिवर्तन हो जाते हैं। जब ऐसे परिवर्तन जीव के लिए सकारात्मक होते हैं, तो वह अपने परिवेश में बेहतर ढंग से काम करता है। किन्तु यदि यह उत्परिवर्तन जीव को नकारात्मक ढंग से प्रभावित करता है तो अक्सर वह जीव असमय मृत्यु को प्राप्त होता है। इस तरह से किसी प्रजाति के गुणधर्म क्रमश: उन्नत होते जाते हैं किन्तु यह बहुत धीमी प्रक्रिया होती है।
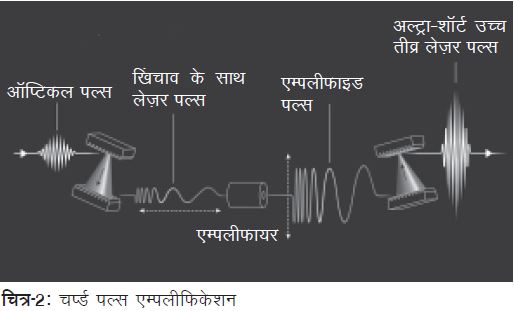
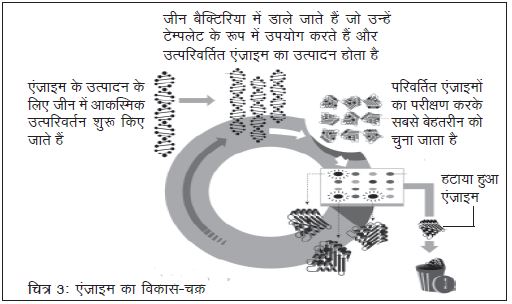 अनाîल्ड ने औषधियाँ, प्लास्टिक व अन्य रसायन बनाने की नई विधियाँ विकसित कीं जो ऊपर वर्णित पद्धति पर आधारित थीं। इसके लिए उन्होंने सजीवों में कुदरती तौर पर पाए जाने वाले एंज़ाइम का उपयोग किया। पहले किसी एंज़ाइम विशेष को कोड करने वाले जीन की कई प्रतिलिपियाँ बनाई गईं। होता यह है कि यदि किसी एंज़ाइम का जीन बैक्टीरिया के डीएनए में जोड़ दिया जाए तो वह उसकी प्रतिलिपि बनाता है। प्रतिलिपि बनाने की इस प्रक्रिया में जीन्स में परिवर्तन होते हैं और जीन्स में हुए परिवर्तन के अनुसार एंज़ाइम की संरचना में भी परिवर्तन हो जाते हैं। इसके बाद इस प्रक्रिया में बने सर्वोत्तम एंज़ाइम को चुन लिया गया। अन्तत: इन एंज़ाइम का उपयोग रासायनिक क्रियाओं को गति देने के लिए किया जा सकता है।
अनाîल्ड ने औषधियाँ, प्लास्टिक व अन्य रसायन बनाने की नई विधियाँ विकसित कीं जो ऊपर वर्णित पद्धति पर आधारित थीं। इसके लिए उन्होंने सजीवों में कुदरती तौर पर पाए जाने वाले एंज़ाइम का उपयोग किया। पहले किसी एंज़ाइम विशेष को कोड करने वाले जीन की कई प्रतिलिपियाँ बनाई गईं। होता यह है कि यदि किसी एंज़ाइम का जीन बैक्टीरिया के डीएनए में जोड़ दिया जाए तो वह उसकी प्रतिलिपि बनाता है। प्रतिलिपि बनाने की इस प्रक्रिया में जीन्स में परिवर्तन होते हैं और जीन्स में हुए परिवर्तन के अनुसार एंज़ाइम की संरचना में भी परिवर्तन हो जाते हैं। इसके बाद इस प्रक्रिया में बने सर्वोत्तम एंज़ाइम को चुन लिया गया। अन्तत: इन एंज़ाइम का उपयोग रासायनिक क्रियाओं को गति देने के लिए किया जा सकता है।
शरीर बैक्टीरिया और वायरस से अपनी रक्षा करने के लिए एंटीबॉडी बनाता है। एंटीबॉडी असामान्य वृद्धि कर रही कोशिकाओं को भी पहचान लेती हैं और उन्हें नष्ट कर देती हैं। सर ग्रेगरी ने स्मिथ की फेज़-डिस्प्ले तकनीक के आधार पर एंटीबॉडी बनने की प्रक्रिया का अध्ययन किया। (स्मिथ की फेज़-डिस्प्ले तकनीक में वायरस को किसी बैक्टीरिया को संक्रमित करने का अवसर दिया जाता है। वायरस में एक ज्ञात प्रोटीन का जीन जोड़ा जाता है। जब वायरस की एक नई पीढ़ी तैयार हो जाती है तो प्रत्येक वायरस को एंटीबॉडी की मदद से अलग कर लिया जाता है। बाहर से जोड़े गए जीन का प्रोटीन वायरस की सतह पर प्रकट हो जाता है। इसलिए इसे फेज़-डिस्प्ले तकनीक कहते हैं।)
इस अध्ययन का एक बड़ा फायदा यह है कि इस तरह बनी एंटीबॉडी का उपयोग औषधियाँ बनाने में किया जा सकता है। ये एंटीबॉडी आत्म-प्रतिरक्षा रोगों की रोकथाम कर सकती हैं और मेटास्टेटिक कैंसर के इलाज में मददगार हो सकती हैं। इस शोध कार्य के आधार पर जो पहली औषधि बनाई गई है, उसका उपयोग रुमेटिक आर्थ्राइटिस, सोरिएसिस वगैरह में किया जा रहा है।
अन्त में
ये पुरस्कार उन उपलब्धियों के लिए प्रदान किए गए हैं जिनसे हमें अत्यन्त लाभ हुआ है और आगे की प्रगति के लिए नया रास्ता खुलता है।
कोकिल चौधरी: संदर्भ पत्रिका से सम्बद्ध हैं।
अँग्रेज़ी से अनुवाद: सुशील जोशी: एकलव्य द्वारा संचालित स्रोत फीचर सेवा से जुड़े हैं। विज्ञान शिक्षण व लेखन में गहरी रुचि।