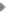सुशील जोशी
 बीसवीं सदी में हमने यह मानकर प्रवेश किया था कि तत्व शुद्ध पदार्थ हैं और तत्वों के संयोजन से ही समस्त पदार्थ बने हैं। उस समय तक तत्वों की आवर्त सारणी (तत्वों को परमाणु भार के हिसाब से जमाकर) भी लगभग पूरी हो चुकी थी, हालांकि कहीं-कहीं समस्याएं आ रही थीं। कई तत्वों को उनके परमाणु भार के क्रम में रखने पर वे ऐसे तत्वों की संगत में पहुंच जाते थे जिनके गुण उनसे अलग होते थे। इसी प्रकार से यह माना गया था कि सारे तत्वों का परमाणु भार हाइड्रोजन के परमाणु भार (यानी 1)
बीसवीं सदी में हमने यह मानकर प्रवेश किया था कि तत्व शुद्ध पदार्थ हैं और तत्वों के संयोजन से ही समस्त पदार्थ बने हैं। उस समय तक तत्वों की आवर्त सारणी (तत्वों को परमाणु भार के हिसाब से जमाकर) भी लगभग पूरी हो चुकी थी, हालांकि कहीं-कहीं समस्याएं आ रही थीं। कई तत्वों को उनके परमाणु भार के क्रम में रखने पर वे ऐसे तत्वों की संगत में पहुंच जाते थे जिनके गुण उनसे अलग होते थे। इसी प्रकार से यह माना गया था कि सारे तत्वों का परमाणु भार हाइड्रोजन के परमाणु भार (यानी 1)
जैसा कि अक्सर कहा जाता है कि तत्व शुद्ध पदार्थ हैं। तो स्वाभाविक प्रश्न उठता है कि फिर इनके परमाणु भार भिन्न संख्याओं में क्यों मिलते हैं? आवर्त सारणी में जब रेडियोएक्टिव पदार्थों से बनने वाले कई सारे तत्व एक ही समूह में रखे जाने लगे तो मामला कैसे सुलझा। पढ़िए इस लेख में......
के गुणज के बराबर होगा। यह सिद्धांत प्राउट ने प्रतिपादित किया था। अर्थात सारे तत्वों के परमाणु भार पूर्णांक संख्याएं होना चाहिए। मगर यहां भी कुछ समस्या आ रही थी। प्रायोगिक तौर पर मापन करके गणना करने पर अधिकांश तत्वों के परमाणु भार भिन्न संख्याओं में आते थे। लिहाज़ा प्राउट का सिद्धांत खटाई में पड़ चुका था।
आवर्त सारणी और परमाणु भार की समस्या एक महत्वपूर्ण गुत्थी थी और इसे सुलझाने में कई बरस लगे। इस मामले में हमारी समझ बढ़ाने का श्रेय वैसे तो उन सभी को जाता है जिन्होंने रेडियो सक्रिय तत्वों की खोज की और उनके विखंडन का गहराई से अध्ययन किया मगर इस संदर्भ में फ्रेडरिक सॉडी का योगदान सर्वोपरि माना जाना चाहिए। फ्रेडरिक सॉडी ने ही यह अवधारणा प्रस्तुत की जिसकी मदद से रेडियो सक्रिय पदार्थों के विखंडन को समझना संभव हुआ और आवर्त नियम में संशोधन भी ज़रूरी हो गया।
रेडियो सक्रिय पदार्थ
कई रसायनज्ञों के अथक परिश्रम मे यह पता चला था कि प्रकृति में कई ऐसे तत्व मिलते हैं जो पड़े-पडे विकिरण छोड़ते रहते हैं। सबसे पहले यूरेनियम में यह गुण देखा गया। यूरेनियम के लवणों के पास रखी फोटोग्राफिक प्लेट पर कुछ रासायनिक क्रिया हो जाती थी। यानी कहीं से इस पर कुछ किरणें पड़ रही थीं। ये किरणें कहां से आई? और सबसे बड़ी बात तो यह थी कि का कोई भी लवण लें, ये किरणें जरूर निकलती थीं। फिर मेरी क्यूरी ने कुछ अन्य पदार्थों में इमी गुण की खोज की। उन्होंने पाया कि थोरियम धातु के यौगिकों में यह गुण होता है। उन्होंने यह भी देखा कि यूरेनियम के कुछ खनिज तो यूरेनियम से भी ज्यादा सक्रिय थे। मेरी क्यूरी ने दो ऐसे तत्वों पोलोनियम और रेडियम की खोज की, और उन्होंने ही इन पदार्थों को यह नाम दिया - रेडियो सक्रिय (रेडियोएक्टिव)।
इसके बाद नंबर आया इन पदार्थों से निकलने वाले विकिरण (रेडिएशन) के अध्ययन का। इसके अलावा यह अध्ययन भी शुरू हो गया कि विकिरण निकलने के बाद जो पदार्थ बचता है। उसकी प्रकृति क्या होती है। 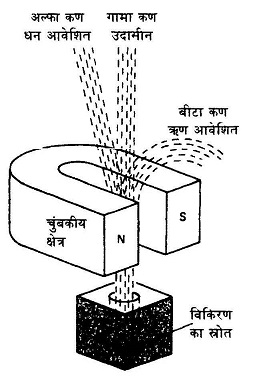 विकिरण की प्रकृति
विकिरण की प्रकृति
इन रेडियो सक्रिय पदार्थों मे निकलने वाली किरणें तीन तरह की पाई गईं। इन्हें अल्फा, बीटा और गामा किरणों के नाम दिए गए। बीसवीं सदी की शुरुआत में ऐसे महत्वपूर्ण प्रयोग किए गए जिनसे हमें परमाणु की संरचना समझने में बहुत मदद मिली है। इन प्रयोगों में पदार्थ और विकिरण के परस्पर प्रभावों का अध्ययन एक महत्वपूर्ण तरीका बना। रेडियो सक्रिय पदार्थों से निकलने वाले विकिरण का अध्ययन करना, इस विकिरण के विभिन्न रूप पहचानना, उनके गुणधर्मों का अध्ययन करना। इन विभिन्न विकिरणों की बौछार तत्वों पर करके असर देखना वगैरह इस दौर के कार्य थे।
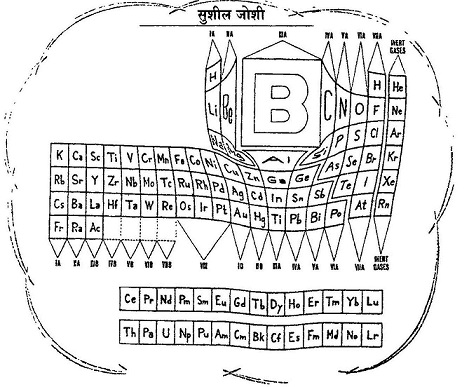
के विख्यात प्रयोगों से यह स्पष्ट हुआ कि ये विभिन्न विकिरण दरअसल कणों की बौछार है। तो इन कणों की प्रकृति की जांच शुरू हुई। यह देखा गया कि अल्फा और बीटा कण जब विद्युत या चुंबकीय क्षेत्र में से गुजरते हैं तो अपने रास्ते से भटक जाते हैं। इससे साफ हो गया कि ये आवेशित कण हैं। यह भी पता चला कि अल्फा कणों और बीटा कणों पर परस्पर विपरीत आवेश हैं - अल्फा कणों पर धनावेश और बीटा कणों और ऋणावेश। इन कणों के आवेश और संहति के अनुपात (e/m) भी निकाले गए। कुल मिलाकर यह स्थापित हुआ कि अल्फा कण मूलत: हीलियम का केंद्रक है जबकि बीटा कण एक इलेक्ट्रॉन है। अल्फा कण का हीलियम होना कई अन्य प्रयोगों से भी साबित किया गया था।
हीलियम को तो आप जानते ही हैं। इसके केन्द्रक में 2 प्रोटॉन और 2 न्यूट्रॉन हैं। जब किसी रेडियो सक्रिय तत्व में से एक हीलियम केन्द्रक (अल्फा कण) निकल जाएगा तो उस पर क्या असर पड़ेगा? उसका भार चार इकाई कम हो जाएगा और आवेश दो इकाई कम हो जाएगा। दरअसल कुछ अत्यंत नफीस प्रयोगों से यह स्थापित किया गया कि जब किसी तत्व से अल्फा कण निकलते हैं तो ये सचमुच हीलियम के धनात्मक आयने ही होते हैं। दूसरी ओर यदि बीटा कण निकल जाएं तो तत्व के परमाणु भार में कोई फर्क नहीं पड़ती मगर उस पर ऋणावेश एक इकाई कम हो जाता है। मतलब तुलनात्मक रूप से उस पर एक इकाई धनावेश बढ़ जाता है।
रेडियो सक्रिय तत्वों का विखंडन
इन सब प्रयोगों के चलते सॉडी रेडियो सक्रिय तत्वों के विखंडन का अध्ययन करने में जुटे हुए थे। वे अकेले नहीं थे। कई सारे वैज्ञानिक इसका अध्ययन कर रहे थे। उन्होंने कई सारे रेडियो सक्रिय तत्वों के विखंडन से उत्पन्न उत्पादों की जांच की और प्रत्येक तत्व की विखंडन श्रृंखला तैयार की। मसलन यूरेनियम, रेडियम, थोरियम वगैरह। इन श्रृंखलाओं से कई रोचक परिणाम निकलने लगे। ये परिणाम इतने हैरतअंगेज़ थे कि शुरू में तो लोगों को इन पर विश्वास भी नहीं हुआ। मगर अकाट्य प्रमाणों के मद्देनजर इन्हें स्वीकार करना ज़रूरी हो गया और इन परिणामों के लिए सॉडी को नोबल पुरस्कार से नवाजा गया। इन्हीं के फलस्वरूप तत्वों को लेकर हमारी समझ पुख्ता हुई और आवर्त सारणी को फिर से लिखा गया। तो, ये परिणाम क्या थे?
होता यह है कि जब किसी रेडियो सक्रिय तत्व का विखंडन होता है तो उसके नतीजतन कोई नया तत्व बन जाता है। हो सकता है कि यह नया तत्व भी रेडियो सक्रिय हो तथा आगे भी विखंडित हो जाए। यह प्रक्रिया तब तक चलेगी जब तक कि स्थिर तत्व न बन जाए। रसायनज्ञ इन मारे विखंडन उत्पादों का अध्ययन करते और उन्हें अलग-अलग तत्व मानते। आवर्त सारणी में इन सबके लिए जगह कहां है? बहादुर शाह ज़फर के शब्दों में, इतनी जगह कहां है दिले दारदार में।''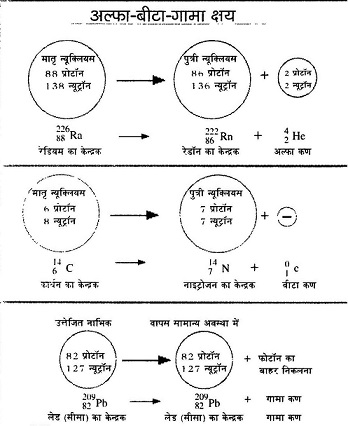 अल्फा, बीटा और गामा: रेडियो सक्रिय पदार्थों से निकलने वाली किरणों को अल्फा, बीटा और गामा नाम दिए गए। जब इन कणों की प्रकृति की जांच शुरू हुई तो यह देखा गया कि अल्फा और बीटा कण जब विद्युतचुंबकीय क्षेत्र में से गुजरते हैं तो अपने रास्ते से विचलित हो जाते हैं जबकि गामा किरणें ऐसे क्षेत्र के प्रति उदासीन रहती हैं।
अल्फा, बीटा और गामा: रेडियो सक्रिय पदार्थों से निकलने वाली किरणों को अल्फा, बीटा और गामा नाम दिए गए। जब इन कणों की प्रकृति की जांच शुरू हुई तो यह देखा गया कि अल्फा और बीटा कण जब विद्युतचुंबकीय क्षेत्र में से गुजरते हैं तो अपने रास्ते से विचलित हो जाते हैं जबकि गामा किरणें ऐसे क्षेत्र के प्रति उदासीन रहती हैं।
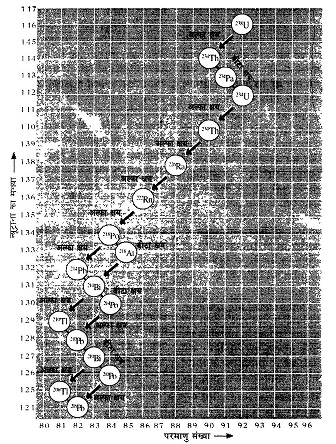
अल्फा क्षयः अल्फा कण 2 प्रोटॉन और 2 न्यूट्रॉन से मिलकर बने होते हैं। इसलिए जब किसी नाभिक में से एक अल्फा क्षय होता है तो नए बने नाभिक के परमाणु भार में की कमी और परमाणु संख्या में 2 की कमी आ जाती है। उदाहरण के लिए रेडियम नाभिक मे रेडॉन नाभिक का बनना देखिए।
बीटा क्षयः यहां बीटा क्षय के उदाहरण में कार्बन नाभिक से नाइट्रोजन नाभिक का बनना दिखाया गया है। आप गौर करेंगे कि एक ऋण आवेश (इलेक्ट्रॉन) बाहर निकल गया है।
एक-एक समूह में कई-कई तत्व हो गए। उस समय (1911 में) वान डेन ब्रोक ने एक नियम प्रतिपादित किया कि जब किसी तत्व में से अल्फा कण निकल जाता है तो वह आवर्त सारणी में दो स्थान बाईं ओर खिसक जाता है। जैसे यदि मूल तत्व आवर्त सारणी के समूह 4 में हैं तो अल्फा विखंडन के बाद नया बना तत्व समूह 2 में पहुंच जाएगा। इसी प्रकार से बीटा विखंडन के बाद बना तत्व आवर्त्त सारणी में एक स्थान दाईं ओर खिसक जाता है। खिसक जाता है मतलब नए बने तत्व के गुण उस समूह के तत्व जैसे होते हैं। ऐसा करते-करते आवर्त सारणी के एक-एक समूह में कई तत्व हो गए। यहां देखने वाली बात यह है कि ना तत्व का परमाणु भार और उसे समूह में पहले से मौजूद तत्व का परमाणु भार अलग-अलग होंगे। हम देख ही चुके हैं कि अल्फा कण निकल जाने से तत्व का परमाणु भार 4 इकाई कम होता है जबकि उसके केन्द्रक में धनावेश 2 इकाई कम होता है। आवर्त मारणी के समूह परमाणु भार के क्रम में बने थे। 'थे' कहने का कारण आगे स्पष्ट होगा।
इस मोड़ पर गफलत फैलना स्वाभाविक था। इसी गफलत को सुलझाने का श्रेय सॉडी को जाता है। सबसे पहले तो उन्होंने इस बात पर ध्यान दिया कि विखंडन से दो तरह के परिवर्तन हो सकते हैं। पहला बीटा विखंडन के फलस्वरूप जो नया तत्व बनता है उसका परमाणु भार तो मूल तत्व के बराबर ही होता है मगर इसके गुण आवर्त सारणी में दाईं ओर के अगले तत्व के समान होते हैं। अतः मूल तत्व और नए तत्व को समभारी (आइसोबार) कहा गया। इन दो तत्वों के गुण एक-दूसरे से भिन्न होते हैं।
अब अल्फो विखंडन का मामला देखें। अल्फा विखंडन के फलस्वरूप जो नया तत्व बनता है उसके गुण आवर्त सारणी में दो स्थान बाईं ओर के तत्व के समान होते हैं जबकि उनके परमाणु भार अलग-अलग हैं। इन तत्वों के गुण इतने समान होते हैं कि इन्हें एक-दूसरे से अलग करना उस समय तो असंभव ही साबित हुआ।
चूंकि आवर्त सारणी में ये एक ही स्थान पर थे, इन्हें समस्थानिक (आइसोटोप) कहा गया। इसका एक और रोचक उदाहरण भी सामने आया।
बीटी क्षय के दौरान पुत्री न्यूक्लियस में एक न्यूट्रॉन कम हो गया है और एक प्रोटॉन बढ़ गया है। निश्चित तौर पर न्यूट्रॉन एक प्रोटॉन और इलेक्ट्रॉन में तब्दील हो गया है।
गामा क्षयः परमाणु के नाभिक में भी इलेक्ट्रॉन की तरह ऊर्जा स्तर होते हैं। उत्तेजित अवस्था में पहुंचा नाभिक जब पुनः सामान्य अवस्था में लौटता है तो गामा कणों को छोड़ता है। गामा कर्ण फोटॉन ही हैं। यहां लेड (सीसे) के नाभिक का उदाहरण दिया गया है।
 |
मान लीजिए किसी तत्व में एक अल्फा विखंडन होता है और उसके बाद दो बीटा विखंडन होते हैं। इस तरह होने पर जो नया तत्व बनेगा वह आवर्त सारणी में उसी ग्थान पर होगा जहां मूल तत्व था जबकि उसका परमाणु भार चार इकाई कम होगा।
इस तरह के तमाम उदाहरण प्रयोगों द्वारा प्राप्त होने लगे थे। ये प्रयोग मूलतः रेडियो सक्रिय तत्वों पर किए गए थे। तथा प्रत्येक मामले में विखंडन की पूरी-पूरी श्रृंखलाएं तैयार की जा चुकी थीं। इस तरह के सारे उदाहरणों में देखा गया कि समस्थानिकों को रासायनिक विधियों से अलग-अलग करना तो बिल्कुल ही असंभव था। ये रासायनिक तौर पर एकदम एक जैसे थे। फिर इनके अस्तित्व का प्रमाण कैसे मिले? यह प्रमाण कुछ समय बाद मिला।
मगर इन प्रयोगों और उनके आधार पर विकसित अवधारणा से इतना स्पष्ट हो गया कि तत्वों के रासायनिक गुण उनके परमाणु भार पर निर्भर नहीं होते। आखिर समस्थानिकों के परमाणु भार तो अलग-अलग हैं। दूसरी ओर समभारी तत्वों के परमाणु भार एक से होने के बावजूद उनके गुण अलग-अलग हैं। इस मोड़ पर परमाणु के किसी अन्य मूलभूत गुण की खोज जरूरी हो गई। यह गुण था परमाणु संख्या। परमाणु संख्या से आशय उस तत्व के परमाणु में उपस्थित इलेक्ट्रॉन से है। किसी तत्व के परमाणु में जितने इलेक्ट्रॉन हैं, उतने ही प्रोटॉन होते हैं। अत: प्रोटॉन की संख्या को भी परमाणु संख्या कह सकते हैं। जब तत्वों को उनकी परमाणु संख्या के आधार पर जमाया गया तो आवर्त सारणी की कई समस्याएं स्वत: दूर हो गई।
अब हम समझ सकते हैं कि आइसोटोप का अर्थ क्या है। दरअसल किसी भी तत्व के परमाणु में इलेक्ट्रॉन और प्रोटॉन के अलावा एक तीसरा कण भी होता है - न्यूट्रॉन। न्यूट्रॉन का भार तो प्रोटॉन के बराबर होता है मगर इस पर आवेश नहीं होता। इलेक्ट्रॉन का भार नगण्य माना जा सकता है। अतः किसी भी तत्व का परमाणु भार उममें उपस्थित प्रोटॉन व न्यूट्रॉन की संख्या पर निर्भर करता है जबकि उसके रासायनिक गुण मात्र
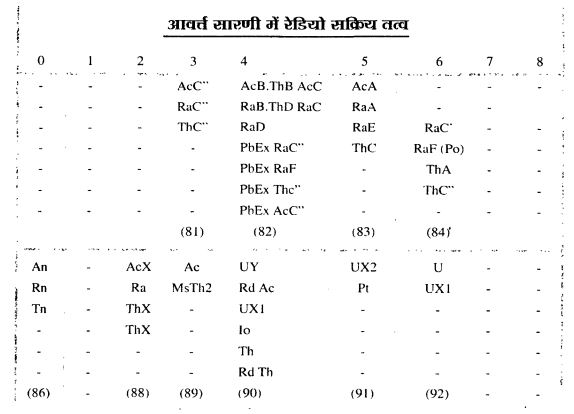
रेडियो सक्रिय तत्वः आवर्त तालिका में ग्रुप 'ए' एवं 'बी' में विभिन्न रेडियो सक्रिय तत्वों की स्थिति दर्शायी गई है। जिससे स्पष्ट होता है कि एक ही परमाणु क्रमांक पर कई रेडियो सक्रिय तत्वों के स्वरूप पाए जाते हैं।
तालिका में विभिन्न तत्वों के साथ उनके किस स्वरूप की बात हो रही है यह भी दर्शाया गया है। उदाहरण के लिए रेडियम ‘ए’ (Ra-A), रेडियम 'बी' (Ra-B), थोरियम ‘डी' (ThD), सीमा 'इ' (Pb-E) आदि।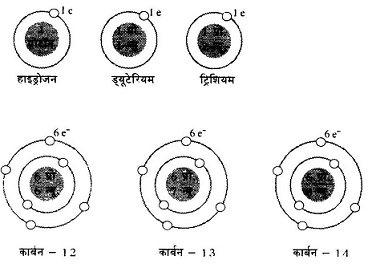
परमाणु संख्या अर्थात प्रोटॉन की संख्या पर निर्भर होते हैं। एक ही परमाणु संख्या वाले परमाणु में अलग-अलग संख्या में न्यूट्रॉन होने पर रासायनिक गुण तो नहीं बदलते मगर परमाणु भार जरूर बदल जाता है।
इन नई खोजों के कारण आवर्त्त नियम में बदलाव आवश्यक हो गया। पहले माना जाता था कि “तत्वों के गुण उनके परमाणु भार के आवर्त प्रभाव हैं।'' इसमें यह महत्वपूर्ण परिवर्तन किया गया कि “तत्वों के गुण उनकी परमाणु संख्या के आवर्त फल हैं।'' ऐसा लगता है कि यह मात्र एक शब्द का खेल है मगर इसकी पृष्ठभूमि और महत्वपूर्ण परिणाम को ध्यान रखना आवश्यक है।
पुराना मकसद
रेडियो सक्रिय तत्वों के इस तरह के कुदरती विखंडन के बाद वैज्ञानिक प्रयोगशाला में तत्वों को एक-दूसरे में बदलने में सफल रहे। मसलन नाइट्रोजन के परमाणु पर हीलियम आयन (अल्फा कण) की बौछार करके ऑक्सीजन और हाइड्रोजन प्राप्त हो जाते हैं। बेचारे
आप आसानी से देख सकते हैं कि जहां-जहां अल्फा क्षय हुआ है वहां -वहां नए तत्व की परमाणु संख्या दो कम हुई है और न्यूट्रॉन की संख्या चार कम हुई है। इसी तरह बीटा क्षय की स्थिति में परमाणु क्रमांक तो एक से बढ़ता है लेकिन न्यूट्रॉन की संख्या कम हो जाती है।
| कुछ तत्वों के आइसोटॉप | ||||
| तत्व | प्रकृति में उपलब्धता | परमाणु क्रमांक | संरचना | परमाणु भार |
| हाइड्रोजन -1 हाइड्रोजन -2 हाइड्रोजन -3 कार्बन -1 2 कार्बन -13 कार्बन -14 ऑक्सीजन -16 ऑक्सीजन -17 ऑक्सीजन -18 यूरेनियम -234 यूरेनियम -235 यूरेनियम -238 |
99.98% 0.02% बेहद कम 98.89% 1.11% बेहद कम 99.76% 0.04% 0.20% 0.01% 0.71% 99.28% |
1 1 1 6 6 6 8 8 8 92 92 92 |
1P 1P, 1N 1P, 2N 6P, 6N 6P, 7N 6P, 8N 8P, 8N 8P, 9N 8P, 10N 92P, 142N 92P, 143N 92P, 146N |
1 2 3 12 13 14 16 17 18 234 235 238 |
P प्रोटॉन और N न्यूट्रॉन
किमियागर लोग सोना बनाना चाहते थे। मगर शायद वे साधारण रासायनिक प्रक्रियाओं से उम्मीद लगाए बैठे थे। उनके पास ऐसी तकनीकें भी नहीं थीं कि वे सीधे परमाणु के केन्द्रक तक पहुंच सकते। तो क्या अब हम सोना बना लेंगे? पता नहीं।
परमाणु भार की गुत्थी
वास्तविक प्रयोगों से जब परमाणु भार निकाले जाते हैं तो वे अक्सर पूर्णांक में न आकर भिन्न संख्या में होते हैं। आइसोटोप की बात शुरू तो रेडियो सक्रिय तत्वों से हुई थी मगर जल्दी ही पता चल गया कि अधिकांश तत्वों के एक से अधिक समस्थानिक पाए जाते हैं। मात्र 25 प्रतिशत तत्व ही ऐसे हैं जिनका एक ही समस्थानिक हो। शेष 75 प्रतिशत तत्वों के दो या दो से भी अधिक समस्थानिक पाए जाते हैं, कुदरती तौर पर। इनमें से कुछ समस्थानिक विघटित होते रहते हैं जबकि अधिकांश स्थिर होते हैं।
अब यह समझना आसान है कि क्यों परमाणु भार पूर्णांक में नहीं होते। समस्थानिकों के अध्ययन के दौरान एक और रोचक बात पता चली। उससे पहले यह कह देना जरूरी है कि एक बार समस्थानिक की अवधारणा स्वीकृत हो जाने के बाद कई तत्वों के समस्थानिकों को अलग-अलग करने के प्रयास जोरों से शुरू हो गए थे। सबसे पहले तो रेडियो सक्रिय तत्वों के समस्थानिक अलग-अलग करने का काम हुआ। इस काम में रासायनिक विधियां नाकाम रहीं मगर भौतिक विधियों का उपयोग करके इन्हें अलगअलग किया जाने लगा। आगे चलकर सामान्य (रेडियो सक्रिय के अलावा) तत्वों के समस्थानिक भी अलग-अलग किए गए। जैसे हाइड्रोजन के तीन समस्थानिक अलग-अलग किए गए, इन्हें हाइड्रोजन, डयूटीरियम और ट्रिशियम नाम दिए गए। बहरहाल, विभिन्न विधियों का उपयोग करके समस्थानिक पृथक्करण का काम जब काफी व्यापक तौर पर हुआ तो वह रोचक बात पता चली जिसका जिक्र करते-करते मैं रुक गया था।
प्राकृतिक रूप से प्रत्येक तत्व में उसके विभिन्न समस्थानिकों को अनुपात काफी स्थिर रहता है। इसलिए जब किसी तत्व का परमाणु भार निकाला जाता है तो वह विभिन्न समस्थानिकों के परमाणु भार का आनुपातिक औसत (weighted average) होता है। चूंकि आमतौर पर विभिन्न समस्थानिकों का अनुपात स्थिर रहता है इसलिए तत्व का परमाणु भार एक सा आता है। मगर ऐसा हमेशा नहीं होता। मसलन सीसा (लेड) का परमाणु भार इस बात पर निर्भर रहता है कि उसे किस स्रोत से प्राप्त किया गया है। अलग-अलग स्रोत से प्राप्त करने पर सीसे में उसके विभिन्न समस्थानिक अलग-अलग अनुपात में होते हैं। इसका कारण यह है कि प्रकृति में सीसा विभिन्न रेडियो सक्रिय तत्वों के विखंडन से बनता है।
उपयोग
अंत में हम इस महत्वपूर्ण पहलू पर आते हैं। मैं यहां इनके एक ही उपयोग की बात करूंगा। वह उपयोग है। रासायनिक क्रियाओं की क्रियाविधि को समझना। यह तो हम जानते ही हैं। कि रासायनिक क्रियाओं में परमाणु फिर से जमते हैं। नए-नए बंधन बनते हैं, पुराने बंधन टूटते हैं, परमाणुओं की नई व्यवस्था बन जाती है। हमें तो शुरुआती क्रियाकारी पदार्थ और अंतिम उत्पाद मिलते हैं। फिर कैसे पता चले कि क्रिया के दौरान क्या-क्या हुआ। इसे समझने में समस्थानिक हमारी मदद करते हैं।
एक उदाहरण से इस बात को समझते हैं। यह तो आपको पता ही है। कि हरे पौधे धूप में कार्बन डाई ऑक्साइड और पानी के मेल से कार्बोहायड्रेट बनाते हैं। इस क्रिया को समीकरण के रूप में निम्नानुसार लिख सकते हैं।
6CO2+ 6H2O= C6H1206 +602
ऐसा माना जाता था कि जो ऑक्सीजन प्राप्त होती है यह कार्बन डाईऑक्साइड से आती है। अब उत्पादों को देखकर तो कोई नहीं बता सकता कि ऑक्सीजन कहां से आई। प्रकृति में ऑक्सीजन के दो समस्थानिक पाए जाते हैं - एक वह जिसका परमाणु भार 16 है और दूसरी वह जिसका परमाणु भार 18 है। तो किया यह गया कि कुछ पौधों को ऐसी कार्बन डाई ऑक्साइड दी गई जिसमें जान बूझकर 18 परमाणु भार वाली ऑक्सीजन ही जोड़ी गई थी। पता चला कि प्रकाश संश्लेषण की क्रिया के उपरांत जो ऑक्सीजन प्राप्त हुई उसमें ऑक्सीजन18 नहीं थी। यानी ऑक्सीजन कार्बन डाई ऑक्साइड से नहीं आई थी। इस तकनीक को निशानदेही तकनीक या ट्रेसर तकनीक कहते हैं। इसकी मदद से कई रासायनिक क्रियाओं की गुत्थियां सुलझाई गई हैं। खासतौर से सजीवों में होने वाली रासायनिक क्रियाओं को समझने में यह तकनीक बहुत उपयोगी रही है।
आइसोटोप्स का एक महत्वपूर्ण उपयोग जीवाश्मों की उम्र पता करने में किया जाता है। यह विधि कार्बन के समस्थानिकों के अनुपात के मापन पर आधारित है। प्रकृति में कार्बन के 3 समस्थानिक पाए जाते हैं - कार्बन12, कार्बन-13 और कार्बन-14 तीनों की ही परमाणु संख्या 6 है।
कार्बन 14 रेडियो सक्रिय होता है और धीरे-धीरे विखंडित होता रहता है। जब तक कोई जीव जीवित है तब तक वह प्रकृति से दोनों तरह का कार्बन (प्रकृति में पाए जाने वाले अनुपात में) अवशोषित करता है। इसमें से कार्बन-14 का विखंडन भी होता रहता है। इस तरह से जीवन के दौरान किसी भी जीव में कार्बन के दो
समस्थानिकों का एक अनुपात स्थापित हो जाता है। मगर मृत्यु के बाद बाहर से कार्बन का अवशोषण तो बंद हो जाता है, किन्तु कार्बन-14 का विखंडन जारी रहता है। प्रत्येक तत्व के अस्थिर समस्थानिक के विखंडन की दर निश्चित होती है। अतः कोई जीवाश्म मिलने पर उसमें मौजूद कार्बन के समस्थानिकों (कार्बन-1 2 और कार्बन-14) के अनुपात के आधार पर बताया जा सकता है कि वह जीव कितने वर्ष पूर्व मर गया था।
सुशील जोशी: एकलव्य की ‘स्रोत फीचर सेवा' से जुड़े हैं। स्वतंत्र रूप में विज्ञान लेखन एवं अनुवाद करते हैं।