सुशील जोशी [Hindi PDF, 124 kB]
भाग-1
परमाणु को हम देख नहीं सकते फिर भी इसके बारे में हम काफी कुछ जान पाए हैं। इसकी वजह है कई वैज्ञानिकों की बहुतेरी कोशिशें। परमाणु सिद्धान्त के विकास की कथा काफी रोचक है। इस श्रंखला में पढ़ते हैं कि परमाणु संरचना की आधुनिक समझ कैसे बनी। शुरुआत करते हैं डाल्टन के समय की बातों से
 परमाणु के अस्तित्व की बात से लेकर उसकी संरचना के भेद खोलना विज्ञान की एक अत्यन्त रोचक कथा है। इस कथा में लगातार हमारा सामना ऐसी खोजों से होता है जो परमाणु के प्रत्यक्ष अवलोकन पर आधारित नहीं हैं। दरअसल परमाणु के अस्तित्व की बात ही चन्द रासायनिक तथ्यों की व्याख्या पर टिकी है। इस अर्थ में परमाणु एक ‘भौतिक इकाई’ या ‘वस्तु’ नहीं बल्कि एक अवधारणा है। कम-से-कम यह एक अवधारणा या सैद्धान्तिक मॉडल की भूमिका निभाता नज़र आता है। दूसरी तरह से देखें, तो परमाणु पदार्थ की एक वास्तविक इकाई है, जिसके आधार पर हम तमाम गणनाएँ कर सकते हैं, भविष्यवाणियाँ कर सकते हैं।
परमाणु के अस्तित्व की बात से लेकर उसकी संरचना के भेद खोलना विज्ञान की एक अत्यन्त रोचक कथा है। इस कथा में लगातार हमारा सामना ऐसी खोजों से होता है जो परमाणु के प्रत्यक्ष अवलोकन पर आधारित नहीं हैं। दरअसल परमाणु के अस्तित्व की बात ही चन्द रासायनिक तथ्यों की व्याख्या पर टिकी है। इस अर्थ में परमाणु एक ‘भौतिक इकाई’ या ‘वस्तु’ नहीं बल्कि एक अवधारणा है। कम-से-कम यह एक अवधारणा या सैद्धान्तिक मॉडल की भूमिका निभाता नज़र आता है। दूसरी तरह से देखें, तो परमाणु पदार्थ की एक वास्तविक इकाई है, जिसके आधार पर हम तमाम गणनाएँ कर सकते हैं, भविष्यवाणियाँ कर सकते हैं।
तो परमाणु ने विज्ञान में दो तरह की भूमिकाएँ निभाई हैं। एक है, एक अवधारणा या पदार्थों की संरचना के एक मॉडल के रूप में और दूसरी है, एक वास्तविक इकाई के रूप में जो हमें रासायनिक क्रियाओं को समझने में मददगार ही नहीं, बल्कि उनको नियंत्रित करने के औज़ार भी प्रदान करती है।
यह सवाल कई बार पूछा जाता है (कम-से-कम मुझसे तो कई बार पूछा गया है) कि जब हम परमाणु को देख नहीं सकते तो उस पर भरोसा क्यों करते हैं। क्यों हम मानते हैं कि परमाणु है? और तो और, हम तो परमाणु के बारे में, उसके अन्दरूनी पर्यावरण के बारे में बढ़-चढ़कर इतनी बातें करते हैं कि पूछो मत। तो सवाल यह है कि इन सबका आधार क्या है।
आगे कुछ लेखों में इस सवाल का जवाब देने की कोशिश करूँगा। इसके लिए मैं माध्यम बनाऊँगा परमाणु संरचना की लगातार परिष्कृत होती समझ की कथा को। शायद बहुत दूर तक, अन्त तक नहीं जाऊँगा, वह काम किसी और के लिए छोड़ दूँगा। तो शु डिग्री करते हैं।
गैस के कुछ विचित्र गुण
आधुनिक मायने में परमाणु सिद्धान्त हमें जॉन डाल्टन ने दिया था। यह ज़रूर है कि प्राचीन काल से ही दार्शनिक इस बाबत विचार करते आए थे कि क्या पदार्थ की कोई सबसे छोटी इकाई होती है और उनके बीच इसे लेकर मतभेद थे। दार्शनिक स्तर पर विचार करना अलग बात है और अवलोकन, प्रयोगों की व्याख्या के लिए विचार करना अलग बात है। जब प्रयोग किए गए, अवलोकनों में ज़्यादा सटीकता आई, तो यथार्थ का ज़्यादा गहरा चित्र उभरने लगा। जैसे लोगों ने देखा कि गर्मी पाकर चीज़ें फैलती हैं। खास तौर से गैसों में यह फैलाव बहुत अधिक होता है। तो सवाल उठा कि पदार्थ, और खास तौर से गैसों में गर्मी पाकर प्रसार क्यों होता है।
इसी प्रकार से यह भी देखा गया कि गैसें एक-दूसरे में घुल-मिल जाती हैं। अन्य पदार्थ भी घुलते-मिलते हैं मगर गैसों की तो बात ही कुछ और है। नमक को पानी में घोलेंगे तो घुल जाएगा, मगर मिट्टी के तेल में नहीं घुलेगा। कहने का मतलब कि ठोस और द्रवों के घुलने में कुछ पसन्द-नापसन्द होती है। इसके अलावा द्रवों में ठोस पदार्थों के घुलने की एक सीमा होती है। मगर गैसें एक-दूसरे के साथ कोई भेदभाव नहीं करतीं। हर गैस किसी भी दूसरी गैस में किसी भी अनुपात में घुल सकती है। सवाल उठा कि गैसें एक-दूसरे में घुल कैसे जाती हैं। क्या उनमें खाली जगह होती है? क्या गैसें कणों से मिलकर बनी हैं जिनके बीच में खाली जगह है?
इसी प्रकार से यह भी देखा गया कि जब गैसों को आपस में घोला जाता है तो उनके घनत्व कुछ भी हों, वे एकसार मिश्रण बनाती हैं। इसका मतलब हुआ कि मिश्रण में उपस्थित सारी गैसें एक-दूसरे से पूरी तरह स्वतंत्र रूप से व्यवहार करती हैं।
मात्रात्मक प्रयोगों से संकेत
जब रासायनिक प्रयोग और खास तौर से मात्रात्मक रासायनिक प्रयोग होने लगे तो ऐसी कई बातें स्पष्ट हुईं। इनमें एक थी -- पदार्थों में होने वाले परिवर्तनों के दौरान चाहे नए पदार्थ बन जाएँ, मगर शुरुआत आपने जितनी कुल मात्रा से की थी, अन्त में उतनी ही मात्रा मिलेगी; न कम, न ज़्यादा। यह बात हर परिवर्तन, हर प्रक्रिया के मामले में सही पाई गई तो इसे एक नियम का रूप दे दिया गया - संहति संरक्षण का नियम (law of conservation of mass)। नियम यह है कि किसी भी रासायनिक क्रिया के पहले और बाद पदार्थों की कुल संहति बराबर रहती है। इसे पदार्थ की अनश्वरता का नियम भी कहते हैं।
दूसरी बात यह हुई कि हम पदार्थों के प्रकार पहचानने लगे। हमने मिश्रण और शुद्ध पदार्थों के बीच अन्तर करना सीखा। पदार्थों को अलग-अलग करने की विधियाँ विकसित होती जा रही थीं। कई शुद्ध पदार्थ मिश्रण साबित हो रहे थे। धीरे-धीरे हम यह समझ पाए कि शुद्धता की पहचान कैसे की जाए।
फिर शुद्ध पदार्थ भी दो प्रकार के पाए गए। कुछ शुद्ध पदार्थ ऐसे हैं जिन्हें तथाकथित रासायनिक क्रियाओं द्वारा दो या अधिक किस्म के शुद्ध पदार्थों में विभाजित किया जा सकता है। दूसरे शुद्ध पदार्थ ऐसे हैं, जिन्हें आप जो भी करें, अलग-अलग किस्म के पदार्थों में पृथक नहीं किया जा सकता। ये बाद वाले शुद्ध पदार्थ तत्व कहलाए, जबकि प्रथम प्रकार के शुद्ध पदार्थों को यौगिक कहा गया।
ये सारी बातें किसी एक वैज्ञानिक ने सपने में देखकर या आराम-कुर्सी पर बैठे-बैठे पता नहीं की थीं। ये बातें तो प्रयोगों और अवलोकनों की एक लम्बी परम्परा का परिणाम थीं।
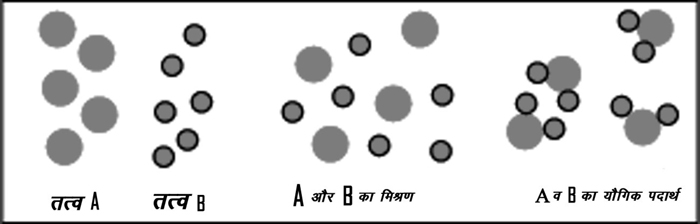
अब तत्व तो ऐसे शुद्ध पदार्थ हैं, जिन्हें और विभाजित नहीं किया जा सकता। मगर यौगिकों का आगे विश्लेषण सम्भव है। कई यौगिकों का विश्लेषण कर-करके यह पता करने की कोशिशें हुईं कि वे किन तत्वों से मिलकर बने हैं। इन प्रयासों से एक और नियम निकला। यह देखा गया कि कोई यौगिक लें तो वह हमेशा उन्हीं तत्वों से मिलकर बना होता है। जैसे पानी कहीं का भी हो, उसके विश्लेषण से पता चलता है कि वह दो तत्वों के योग से बना होता है - हाइड्रोजन व ऑक्सीजन। यह तो हुई गुणात्मक विश्लेषण की बात। मगर जब मात्रात्मक विश्लेषण की तकनीकें हाथ में आईं तो एक और बात पता चली। कोई भी यौगिक हमेशा उन्हीं तत्वों से और उन तत्वों के उसी अनुपात के योग से बनता है। यह नियम भी हर मामले में लागू होता देखा गया और इसे स्थिर अनुपात का नियम (law of constant proportion) कहा गया।
एक तीसरा नियम भी पता चला। यह थोड़ा घुमावदार था मगर था तो एक ऐसा नियम जो तत्वों के परस्पर रासायनिक व्यवहार को व्यक्त करता था। जब रसायन शास्त्रियों ने तमाम तत्वों और यौगिकों के व्यवहार को मात्रात्मक ढंग से रिकॉर्ड करना शु डिग्री किया तो व्युत्क्रम अनुपात का नियम (law of reciprocal proportion) सामने आया। यह नियम तब लागू होता है जब कोई तीन तत्व आपस में दो-दो की जोड़ियों में क्रिया करके अलग-अलग यौगिक बनाते हैं। कहने का मतलब है कि तीन तत्व हैंA B औरC। अब मामला यह है कि A औरB क्रिया करेंगे, A और C क्रिया करेंगे तथा B और C की क्रिया होगी। तीन यौगिक बनेंगे - AB, AC और BC। अब यदि आप इन यौगिकों में क्रमश: A और B के बीच का अनुपात देखें, Bऔर C के बीच का अनुपात देखें तो Aऔर C के बीच के अनुपात का अन्दाज़ लगा सकते हैं। उदाहरण के लिए मान लीजिए कि A और Bके बीच क्रिया वज़न के 1:2 के अनुपात में होती है और A और C के बीच क्रिया 1:3 के अनुपात में होती है, तो B और Cके बीच क्रिया में उनका अनुपात 2:3 का होगा।
डाल्टन का योगदान
डाल्टन ने जब परमाणु सिद्धान्त पेश किया, तब पदार्थों के आपसी रासायनिक व्यवहार के यही तीन नियम हम जानते थे - संहति के संरक्षण का नियम, स्थिर अनुपात का नियम और व्युत्क्रम अनुपात का नियम। डाल्टन ने यह देखा नहीं था कि जब पदार्थ आपस में क्रिया करते हैं, तो अन्दर क्या होता है। उन्होंने अन्दाज़ लगाया कि ऐसा क्या हो रहा होगा कि ये नियम हर बार खरे उतरते हैं। बस इसी में से परमाणु सिद्धान्त निकला।
सबसे पहले उन्होंने एक मान्यता रखी - सारे पदार्थ परमाणुओं से बने होते हैं। यही पदार्थ का सबसे छोटा हिस्सा होता है। इस मान्यता की बुनियाद क्या है? ऐसा लगता है कि परमाणु का विचार डाल्टन ने अपने पूर्ववर्तियों से हासिल किया था। मगर डाल्टन ने इस विचार में एक नई बात जोड़ी। डाल्टन की पुस्तक रसायन शास्त्र का नया दर्शन का एक अंश पढ़िए जिसमें वे परमाणुओं के बारे में एक महत्वपूर्ण विचार का तर्क प्रस्तुत कर रहे हैं।

“पदार्थ तीन अवस्थाओं में रह सकते हैं - गैस, द्रव और ठोस। इसका एक मशहूर उदाहरण पानी के रूप में देखा जा सकता है। यह अलग-अलग परिस्थितियों में तीनों अवस्थाओं में रह सकता है। ...इन अवलोकनों के आधार पर यह अनकहा निष्कर्ष निकला है कि सारे पदार्थ, चाहे ठोस हों या तरल, निहायत छोटे-छोटे कणों अथवा परमाणुओं की विशाल संख्या से बने हैं ...। यह निष्कर्ष पूरी तरह सन्तोषजनक प्रतीत होता है और यहाँ मेरा मकसद इस निष्कर्ष पर सवाल खड़ा करना नहीं है। मेरा मकसद यह दर्शाने का है कि हमने अब तक इस निष्कर्ष का कोई उपयोग नहीं किया है। इस उपेक्षा का नतीजा है कि रासायनिक क्रियाओं का एक निहायत धुँधला नज़रिया उभर पाया है।”
ऐसा नहीं था कि पदार्थों के एक बुनियादी कण की बात करने वाले डाल्टन पहले व्यक्ति थे। प्राचीन काल से ही दार्शनिक स्तर पर ऐसे कण की बात चली आ रही थी। आधुनिक विज्ञान में भी गैसों के दबाव, गैसों के परस्पर घुलने वगैरह की व्याख्या के लिए अलग-अलग नामों से एक बुनियादी कण की चर्चाएँ चल रही थीं। डाल्टन ने इन विभिन्न विचारों को साथ रखकर एक सुसंगत व्याख्या करने के प्रयास में परमाणु को प्रस्तुत किया था और ‘इस निष्कर्ष का उपयोग’ करने का एक रास्ता दर्शाया था जिसके चलते रासायनिक क्रियाओं की बेहतर समझ बनी।
अब इस एक मान्यता में से कई बातें निकलती हैं। चूँकि रासायनिक क्रियाओं के दौरान अभिकारकों और उत्पादों की मात्रा नहीं बदलती, इसलिए लाज़मी है कि जितने परमाणु शु डिग्री में थे, उतने ही अन्त में भी होने चाहिए। यानी क्रियाओं के दौरान परमाणु नष्ट नहीं होगा।
दूसरी बात उन्होंने कही कि रासायनिक क्रियाओं के दौरान परमाणु पूरा-का-पूरा इधर-उधर होगा, टूटेगा नहीं। इसका आधार क्या है? यदि रासायनिक क्रियाओं के दौरान परमाणु टूटेगा तो स्थिर अनुपात का नियम खतरे में पड़ जाएगा। क्योंकि परमाणु टूटने की स्थिति में जो यौगिक बनेंगे उनमें किसी तत्व की मनमानी मात्रा जा सकती है। हर बार यौगिक के एक-एक कण में परमाणु का बराबर हिस्सा पहुँचने की बात ज़्यादा मुश्किल लगती है। इसलिए बेहतर होगा कि परमाणु जब जाए, पूरा ही जाए।
परमाणु भार का आकलन डाल्टन के परमाणु सिद्धान्त का तीसरा पहलू यह था कि किसी भी पदार्थ के सारे परमाणु एक जैसे होते हैं और किसी भी अन्य पदार्थ के परमाणुओं से भिन्न होते हैं। अब यह बात कहाँ से आ टपकी? ज़ाहिर है, डाल्टन ने परमाणुओं की परेड तो करवाई नहीं होगी कि चलो भैया एक-एक पदार्थ के परमाणु लाइन में आते जाओ। इस मामले में भी उन्होंने उन्हीं नियमों और परमाणुओं का तालमेल बनाने की कोशिश की। इस तर्क की बानगी उन्हीं के शब्दों में (रसायन शास्त्र का नया दर्शन),
डाल्टन के परमाणु सिद्धान्त का तीसरा पहलू यह था कि किसी भी पदार्थ के सारे परमाणु एक जैसे होते हैं और किसी भी अन्य पदार्थ के परमाणुओं से भिन्न होते हैं। अब यह बात कहाँ से आ टपकी? ज़ाहिर है, डाल्टन ने परमाणुओं की परेड तो करवाई नहीं होगी कि चलो भैया एक-एक पदार्थ के परमाणु लाइन में आते जाओ। इस मामले में भी उन्होंने उन्हीं नियमों और परमाणुओं का तालमेल बनाने की कोशिश की। इस तर्क की बानगी उन्हीं के शब्दों में (रसायन शास्त्र का नया दर्शन),
“बर्थोलेट द्वारा प्रतिपादित रासायनिक लगाव के नियम के मुताबिक रासायनिक लगाव पदार्थों की मात्रा के समानुपाती होता है और जब पदार्थ आपस में जुड़ते हैं तो वे एक बदलते अनुपात में जुड़ते हैं। मेरे ख्याल में इस विचार का बेतुकापन तर्क और अवलोकन, दोनों आधारों पर ज़ाहिर है।
पानी जैसे किसी पदार्थ के सारे अन्तिम (यानी सबसे छोटे) कण वज़न, आकार वगैरह की दृष्टि से एक जैसे हैं या नहीं, यह सवाल काफी महत्व रखता है। जितना हम जानते हैं, हमें यह शंका करने का कोई कारण नहीं है कि इन मामलों में कोई विविधता होगी। यदि यह विविधता पानी में है तो यह उन तत्वों (हाइड्रोजन और ऑक्सीजन) में भी होगी जिनसे मिलकर पानी बना है। अब यह कल्पना करना तो सम्भव नहीं लगता कि जब (हाइड्रोजन और ऑक्सीजन के) असमान कणों के समूह बनेंगे तो वे इतनी हद तक एक जैसे होंगे। यदि पानी के कुछ कण बाकी कणों से थोड़े भारी होते और तब यदि पानी का कोई कतरा मुख्यत: इन भारी कणों से बना हो तो इसका असर उस कतरे के घनत्व पर ज़रूर पड़ेगा। मगर ऐसा देखा नहीं गया है। इसी प्रकार के अवलोकन अन्य पदार्थों पर भी किए जा सकते हैं।
लिहाज़ा, हम निष्कर्ष निकाल सकते हैं कि समांग पदार्थों के सारे-के-सारे अन्तिम कण वज़न, आकृति वगैरह के लिहाज़ से हूबहू एक जैसे होते हैं। दूसरे शब्दों में पानी का हरेक कण पानी के किसी भी अन्य कण जैसा होता है और हाइड्रोजन का हरेक कण हाइड्रोजन के किसी भी अन्य कण जैसा होता है।”
डाल्टन के सिद्धान्त की सबसे महत्वपूर्ण बात यही है। उन्होंने यह कहा कि किसी भी पदार्थ के सारे कणों का वज़न एक बराबर होगा। दरअसल, पूर्व के सारे ‘परमाणु सिद्धान्तों’ की तुलना में डाल्टन के सिद्धान्त का महत्व इसी बात में निहित है कि उन्होंने परमाणु के एक मापन योग्य गुण (वज़न) की बात की। इसे उन्होंने परमाणु भार कहा।
इसके बाद, इस ‘निष्कर्ष का उपयोग’ प्रतिपादित करने के लिए उन्होंने जो अगला कदम उठाया वह इसी की तार्किक परिणति थी। उन्होंने विभिन्न तत्वों के परमाणु भारों की गणना की। एक बार फिर उपलब्ध आँकड़ों और तर्क का उपयोग करते हुए उन्होंने इस काम को अंजाम दिया।
जो आँकड़े थे उनका सम्बन्ध इस बात से था कि किसी तत्व की कितनी मात्रा किसी दूसरे तत्व की कितनी मात्रा से क्रिया करती है। अठारहवीं सदी के अन्त और उन्नीसवीं सदी के शु डिग्री में हम यह जानते थे कि किसी यौगिक में तत्वों की कितनी-कितनी मात्रा होती है। मान लीजिए 9 ग्राम पानी में 1 ग्राम हाइड्रोजन और 8 ग्राम ऑक्सीजन है। अब इस आँकड़े के आधार पर यह कैसे पता चलेगा कि हाइड्रोजन के एक परमाणु का वज़न कितना है या ऑक्सीजन के परमाणु का वज़न कितना है।
परमाणु भार निकालना
तो पहला काम डाल्टन ने यह किया कि वास्तविक परमाणु भार की बजाय तुलनात्मक (या आपेक्षिक) परमाणु भार निकालने का निर्णय किया। मगर यह भी कैसे सम्भव होता? चलिए आपेक्षिक परमाणु भार निकालने के लिए उन्होंने मान लिया कि हाइड्रोजन का परमाणु भार 1 है। यह मानने का आधार था कि हाइड्रोजन सबसे कम घनत्व वाला तत्व था (और है) तथा किसी भी यौगिक का विश्लेषण करने पर सबसे कम मात्रा हाइड्रोजन की ही आती थी। मगर इससे आगे कैसे बढ़ें? आपको यह तो पता नहीं है कि (उदाहरण के लिए) 1 ग्राम हाइड्रोजन में कितने परमाणु हैं और 8 ग्राम ऑक्सीजन में कितने परमाणु हैं। तो इनकी तुलना कैसे की जाए? इस समस्या का अनोखा समाधान निकला यह मानकर कि जब भी दो तत्व आपस में क्रिया करके एक ही यौगिक बनाते हैं तो यह क्रिया दोनों तत्वों के एक-एक परमाणु के बीच होगी। यानी यदि किन्हीं दो तत्वों का एक ही यौगिक ज्ञात है तो हम मान लेंगे कि उस यौगिक में दोनों तत्वों के परमाणुओं की संख्या बराबर-बराबर है। यदि यह बात मान लें, तो इसका मतलब यह होगा कि 1 ग्राम हाइड्रोजन में जितने परमाणु हैं, उतने ही परमाणु 8 ग्राम ऑक्सीजन में होंगे। अब गणना कर लीजिए कि ऑक्सीजन का एक परमाणु हाइड्रोजन के एक परमाणु से कितना भारी होगा।
डाल्टन ने आगे का रास्ता खोला
रासायनिक तथ्यों का तालमेल परमाणु से बनाने के लिए समय-समय पर ऐसे कई ‘मान लो’ प्रकट हुए हैं। कभी-कभी ये सही साबित हुए हैं, तो कभी-कभी गलत। डाल्टन की यह मान्यता आगे चलकर गलत साबित हुई। मगर यह तो हमें मानना होगा कि एक मान्यता को अपनाकर जब डाल्टन आगे बढ़े तो एक रास्ता खोला। देर-सबेर हम उनकी मान्यता की गलती पहचान पाए और एक नहीं, कई कदम आगे बढ़ पाए। मैं यहाँ परमाणु भार की गुत्थी में उलझने की बजाय एक अन्य मान्यता को परखना चाहूँगा।
डाल्टन के परमाणु सिद्धान्त के मुताबिक परमाणु अविभाज्य है। इस मान्यता का आधार, जैसा कि ऊपर कहा गया, रासायनिक संयोग के नियमों में था। यदि परमाणु पदार्थ की बुनियादी इकाई है तो उससे हमें पदार्थों की प्रकृति के विभिन्न पक्षों की व्याख्या करने में मदद मिलनी चाहिए। चाहे विद्युत हो, ऊष्मा हो या प्रकाश, परमाणु की मदद से हमें इन सबको समझने में मदद मिलनी चाहिए। यह मदद तो मिली मगर कई मामलों में इसके लिए परमाणु की अविभाज्यता पर आँच आई। अगली बार मिलेंगे तो परमाणु को तोड़ेंगे। यह देखेंगे कि क्या परमाणु सबसे बुनियादी इकाई है या परमाणु स्वयं भी कुछ अन्य बुनियादी इकाइयों से बना है।
(...जारी)
सुशील जोशी: एकलव्य द्वारा संचालित स्रोत फीचर सेवा से जुड़े हैं। विज्ञान शिक्षण व लेखन में गहरी रुचि।